Для процессов выщелачивания цинкового огарка решающее значение имеет поведение соединений трех компонентов: основного компонента — цинка и примесных компонентов - железа и кремнезема. Вынужденная совмещенность растворения цинка, железа и SiO2 обусловлена образованием между ними соединений ZnFе2O4 и Zn2SiO4 в процессе обжига.
Изменяя кислотность раствора при кислотном выщелачивании цинка, можно одновременно осаждать растворившиеся железо и Si02 и таким образом отделить их от цинка. В основе этих процессов лежат кислотно-основные взаимодействия.
Из соединений, содержащихся в цинковом огарке, легко растворим в воде ZnS04, оксосульфат цинка растворим в воде:
3 (ZnO·2ZnS04)+7H2O=ZnS04 ·3 Zn(OH)2 ·4H2O+5ZnS04· aq. (9.1)
Прочие из перечисленных соединений цинка нерастворимы в воде. В слабокислом растворе (рН < 3) растворимы ZnSO4 · 3Zn(OH)2, ZnO и Zn2SiO4. Для растворения ZnFe2O4 и ZnS с достаточной для практики скоростью необходимы горячие и весьма кислые растворы (t ≥ 80°C и 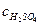 > 50 г/дм3).
> 50 г/дм3).
В огарке значительные количества железа содержатся не только в форме феррита цинка, но также в виде Fe2O3, которая столь же плохо растворяется в кислых растворах, как и ферриты. Однако наличие в огарке остатков сульфидной серы, которая выступает восстановителем Fe(III) в оксиде и ферритах, вызывает переход железа и раствор в состоянии Fe(П). Кремнезем в огарке содержится не только и форме Zn2SiO4, но также в форме свободного SiO2 и других породообразующих минералов. Свободный и связанный в породу SiO2 практически не растворяется в растворах Н2S04.
Различие в поведении соединений цинка, железа и кремнезема, содержащихся в огарке, при его выщелачивании используется в технологии. В гидрометаллургии цинка выщелачивают не только огарки, но и окисленные цинковые руды или полученные из них концентраты, в которых, кроме Zn2SiO4 (виллемит), может содержаться Zn4(OH)2(Si207)·H20 (каламин). Последний, как и виллемит, легко растворяется в слабокислых растворах.
Очистку растворов от железа осуществляют в процессе выщелачивания путем гидролитического осаждения, а попутно благодаря соосаждению и от некоторых других примесей (As, Sb и др.).
Гидролиз Fe3+· aq в сульфатном растворе - это взаимодействие его с водой, в результате которого образуются прочные гидроксокомплексы (малодиссоциированные соединения, т.е. слабые основания). Например:
Fe2(SO 4)3· aq + 2 п Н2О= Fе2(OH)2 п (SO4)3- п · aq + п H2SO4 · aq, (9.2)
или в ионной форме
Fe3+· aq + 4 п Н2О = 2 Fe(OH)n(3 - п)+ · aq + 2п Н3О ·aq. (9.3)
Если в кислом растворе нейтрализовать кислоту огарком, то равновесие реакций (9.2) или' (9,3) сдвигается вправо. Это способствует насыщению раствора гидроксокомплексом железа, который начинает выпадать в осадок в виде труднорастворимого гидроксосоединения железа. Осаждение продукта гидролиза путем нейтрализации Н3О+ называется гидролитическим осаждением.
Технологическое значение в гидрометаллургии цинка имеют ярозит R+ Fe3(OH)6(SO4)2, гетит α-FeOOH, гематит α -Fe2O3, а также аморфный основной сульфат 2 Fе2О3·SO3·nH2O.
Основным источником растворимого кремнезема в огарках или окисленных рудах являются силикаты цинка. Кремнезем переходит в раствор в виде ортокремниевой кислоты:
Zn2Si04 + 2H2S04· aq = 2ZnS04· aq + H4Si04· aq, (9.4)
Есть некоторая область кислотностей раствора (рН ≈ 2,0÷3,5), в которой H4Si04 образует истинный раствор. Если смещаться от области существования истинных растворов кремнекислоты в сторону увеличения кислотности (рН < 2) или в сторону уменьшения кислотности (рН > 3,5), то последовательно образуются золи, гели, коагели и коагуляты, т.е. коллоидные состояния и продукты их разрушения. Продукты разрушения коллоидных растворов кремнекислот при значительных их количествах ухудшают разделение пульпы и показатели выщелачивания.
 2014-02-09
2014-02-09 1207
1207








