В ряду напряжений до водорода стоят более активные металлы, которые вытесняют водород из растворов кислот (со слабыми окислительными свойствами):
Mg + H2SO4 ® MgSO4 + H2
Наиболее активные металлы обладают наиболее отрицательными значениями редокс-потенциалов.
Более активный металл (с более отрицательным потенциалом) вытесняет менее активный металл (с более высоким значением Е0) из раствора его соли:

Cu(s)+2AgNO3(aq) ® Cu(NO3)2(aq)+ 2Ag(s)
E0 = 0.34 V E0 = 0.80 V
Т.е. менее активный металл восстанавливается из раствора в виде свободного металла: Ме2++2е-=Ме
Гальванический элемент – это устройство, в котором за счет энергии, высвобождающейся в ходе окислительно-восстановительной реакции, возникает электрический ток – т.е. химическая энергия преобразуется в электрическую энергию.
Пример: Гальванический элемент Даниеля (1836)
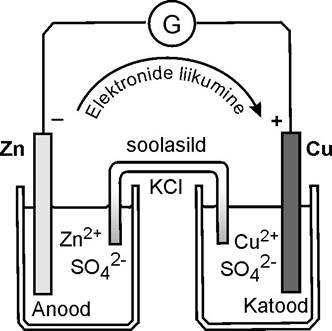
(-) Zn(тв) | ZnSO4(aq) | KClнасыщ | CuSO4(aq) | Cu(тв) (+)
(-) Zn(тв) | Zn2+(aq) || Cu2+(aq) | Cu(тв) (+)
 2014-02-09
2014-02-09 1145
1145








