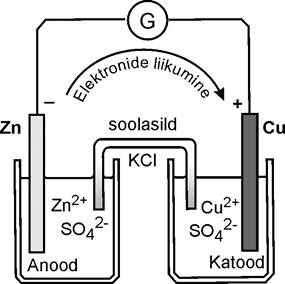
Анод | раствор|мостик| раствор| катод
Cu2+ + 2e– = Cu E° (Cu2+/Cu)= 0.34 В
Катод (+) – электрод, на котором происходит восстановление.
У Cu2+-ионов способность к присоединению электронов выше, чем у цинка
Zn2+ + 2e = Zn E° (Zn2+/Zn)= - 0.76 В
Zn является восстановителем:
Zn → Zn2+ + 2 e– или Zn – 2 e– → Zn2+
Суммарная реакция:
Cu2+ (ж) + Zn (тв) → Cu (тв) + Zn2+ (ж)
В гальванической цепи металл, стоящий в ряду напряжений металлов впереди (т.е. обладающий более низким окислительно-восстановительным потенциалом), является анодом, а стоящий правее - катодом.
Электроны перемещаются от анода к катоду.
 2014-02-09
2014-02-09 1144
1144








