ГАЛОГЕНЫ. ОБЩАЯ ХАРАКТЕРИСТИКА
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Таблица. Электронное строение и некоторые свойства атомов и молекул галогенов.
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | |||||
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Сродство атома к электрону, эв | 3,45 | 3,61 | 3,37 | 3,08 | ~2,8 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Межъядерное расстояние в молекуле Э2, нм | 0,142 | 0,199 | 0,228 | 0,267 | – |
| Энергия связи в молекуле Э2 (25°С), кДж/моль | |||||
| Степени окисления | -1 | -1, +1, +3, +4, +5, +7 | -1, +1, +4, +5, +7 | -1, +1, +3, +5, +7 | – |
| Агрегатное состояние | Бледно-зел. газ | Зел-желт. газ | Бурая жидкость | Темн-фиол. кристаллы | Черные кристаллы |
| t°пл.(°С) | -219 | -101 | -8 | ||
| t°кип.(°С) | -183 | -34 | |||
| r (г*см-3) | 1,51 | 1,57 | 3,14 | 4,93 | – |
| Растворимость в воде (г / 100 г воды) | реагирует с водой | 2,5: 1 по объему | 3,5 | 0,02 | – |
Таблица. Электронное строение и некоторые свойства атомов и молекул галогенов
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | |||||
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Сродство атома к электрону, эв | 3,45 | 3,61 | 3,37 | 3,08 | ~2,8 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Межъядерное расстояние в молекуле Э2, нм | 0,142 | 0,199 | 0,228 | 0,267 | – |
| Энергия связи в молекуле Э2 (25°С), кДж/моль | |||||
| Степени окисления | -1 | -1, +1, +3, +4, +5, +7 | -1, +1, +4, +5, +7 | -1, +1, +3, +5, +7 | – |
| Агрегатное состояние | Бледно-зел. газ | Зел-желт. газ | Бурая жидкость | Темн-фиол. кристаллы | Черные кристаллы |
| t°пл.(°С) | -219 | -101 | -8 | ||
| t°кип.(°С) | -183 | -34 | |||
| r (г*см-3) | 1,51 | 1,57 | 3,14 | 4,93 | – |
| Растворимость в воде (г / 100 г воды) | реагирует с водой | 2,5: 1 по объему | 3,5 | 0,02 | – |
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
Фтор встречается в природе в виде фторидов, например, флюорита CaF2. Фтор получают электролизом расплавов фторидов щелочных металлов. Для понижения температуры плавления электролизу подвергают кислые фториды состава KF. 2HF * ), что позволяет проводить процесс при 1000С (Тпл. чистого KF составляет 8570С). Материалом для электролизера служат медь, никель или сталь, которые покрываются с поверхности плотной пленкой фторида, препятствующей дальнейшей коррозии реактора.
В лабораторных условиях фтор можно получить термолизом высших фторидов некоторых металлов, например,
2CeF4 = 2CeF3 + F2.
Хлор встречается в природе, в основном, в виде хлоридов. Например, известны мощные залежи галита(NaCl), образовавшиеся при испарении соленых морей и озер. Основным методом получения хлора из галита является электролиз концентрированного раствора NaCl с диафрагмой, разделяющей катодное и анодное пространства:
2 NaCl + 2H2O 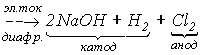
В лабораторных условиях хлор получают взаимодействием концентрированной HCl с такими окислителями, как КMnO4 , а также MnO2, K2Cr2O7 и т.д.
16HCl + 2KMnO4 = Cl2 +2KCl +2MnCl2 + 8H2O.
Реакция твердого KMnO4 с концентрированной HCl протекает с образованием темно-коричневого малорастворимого гексахлороманганата (IV) калия и раствора, содержащего хлоридные комплексы Mn(III):
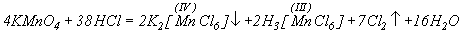
Полное восстановление KMnO4 до MnCl2 осуществляется при большом избытке HCl.
Бром, содержащийся в морской воде и буровых водах в виде бромидов, извлекают путем обработки реакционной смеси хлором при рН=3.5, чтобы избежать образования солей оксокислот брома.
Аналогичным образом из буровых вод и золы, образующейся при сгорании морских водорослей, выделяют иод.
В лаборатории бром и иод получают взаимодействием галогенидов с окислителем (MnO2) в кислой среде, например:
MnO2 + 2H2SO4 + 2KI = I2 + MnSO4 + 2H2O + K2SO4..
Образующийся иод экстрагируют или отделяют перегонкой с водяным паром.
 2014-02-10
2014-02-10 1650
1650








