ПРИМЕНЕНИЕ МЕТОДА В АНАЛИЗЕ
Кислотно-основное титрование в неводных средах позволяет существенно расширить возможности метода. Им определяют сильные, слабые и очень слабые кислоты (индивидуальные вещества, смеси веществ), основания, соли. Метод широко используют в практике фармацевтического анализа для определения разнообразных лекарственных препаратов, которые малорастворимы в воде, проявляют свойства очень слабых кислот или оснований.
Химическая технология - это наука об экономически и экологически обоснованных методах переработки сырья, средства производства и предметов потребления.
Химическая технология состоит из двух основных блоков.
1. изучение теоретических основ протекания химико-технологических процессов на молекулярно кинетическом уровне. Он включает в себя изучение законов термодинамики и кинетики.
2. теоретические основы функционирования химического реактора.
Основная задача курса - получение навыков решения двух задач:
Задача первая- проектирование химического реактора. Суть-при известных значения, управляющих параметрах необходимо рассчитать объем реактора, который обеспечивает требуемы показатели интенсивности работы реактора.
Задача вторая- моделирование реактора пи известном объеме реактора. Исследуется на величину показателей интенсивности работы реактора.
Любой химико-технологический процесс состоит как минимум из трех стадий.
1. подвод реагентов к поверхности раздела фаз или в объем другой фазы.
2. химическое превращение
3. отвод продуктов от поверхности раздела фаз или из объема другой фазы.
Каждая из стадий протекает со своей скоростью, но определяющей является стадия, протекающая с наименьшей скоростью и все остальные подстраиваются под самую медленную, соответственно стадия процесса, обладающая наименьшей скоростью, называется – лимитирующей стадией.
Если скорость первой или третьей стадии меньше чем второй, то процесс протекает в диффузной области и в качестве управляющих выступают макрокинетические параметры, к которым относят:
1. линейная скорость подачи реагентов.
2. степень перемешивания реагентов.
3. размер единичных элементов, принимающих участие в процессе.
Первый закон Фика:
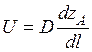
Где U – скорость диффузии, D – коэффициент диффузии.
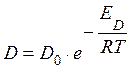
Не зависимо от того какая реакция, скорость будет зависеть от концентрации компонентов в первой степени.
Если скорость второй стадии меньше чем первой и второй, то процесс протекает в кинетической области и управляющими являются микрокинетические параметры:
1. температура
2. давление
3. концентрация
Температура влияет в соответствии с уравнением Аррениуса.
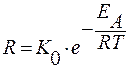
Энергия активации – тот минимальный избыток энергии, который необходимо сообщить реагирующей системе чтобы произошел элементарный акт химической реакции.
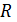 - универсальная газовая постоянная =8,31 Дж/моль*К
- универсальная газовая постоянная =8,31 Дж/моль*К
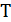 - температура в абсолютной шкале, К.
- температура в абсолютной шкале, К.
К0 -предэкспоненциальный множитель. Константа скорости при температуре равной бесконечности.
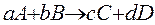
Реакция простая, протекает в один этап.
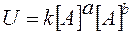
Концентрация- отношение количества вещества ко всему имеющемуся объему.
Доля вещества:
1. Мольная – отношение числа молей компонента к суммарному количеству молей компонентов в смеси. Моль- количество вещества, содержащее такое же число, какое содержится в 12 граммах изотопа углерода.
2. Объемная – отношение объема к суммарному объему вещества. Для систем жидкость – жидкость и в газофазных.
3. Массовая - отношение массы компонента к суммарной массе смеси. Для процессов с участием твердой фазы.
Мольная доля и объемная для газов одинакова.
Степень превращения - отношение количества вещества вступившего в реакцию к начальному количеству вещества. В случае если исходные реагенты находятся в стехиометрическом соотношении, степень превращения по реагентам совпадает.
В подавляющем большинстве случаев реагенты подаются не в стехиометрии, поэтому практическую ценность имеет степень превращения вещества находящегося в недостатке.
Выход продукта - отношение производительности по продукту к максимально возможной производительности по рассматриваемому веществу. Выход по продукту численно совпадает со степенью превращения ключевого компонента.
Расходный коэффициент – это количество исходного реагента, необходимого для производства единицы количества продукта.
Различают теоретический расходный коэффициент, который рассчитывается на основании стехиометрического уравнения и практический, который учитывает чистоту сырья и степень превращения сырья.
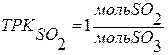
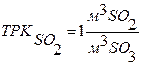
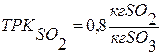
Селективность – величина, используемая в том случае, если в реакторе может протекать одновременно две и более реакции.
Интегральная селективность - это соотношение производительности по ключевому компоненту в целевой реакции к суммарной производительности по всем реакциям протекающим в реакционном объеме. Величина может изменяться от 0 до 1.
Если 1, то все побочные реакции заблокированы.
Если 0, то не протекает целевая реакция.
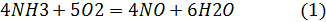
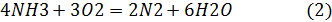
Окисление аммиака в производстве HNO3:
1 реакция целевая, т.к. получаем NO
2 реакция побочная, т.к. аммиак расходуется на получение N2.
Селективность есть производительность по аммиаку.
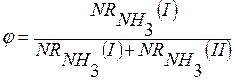
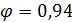 у HNO3 приемлемо.
у HNO3 приемлемо.
Такая селективность достигается двумя путями.
1. использование селективных катализаторов, в виде платиновых сеток.
Диффузная селективность – отношение скорости целевой реакции к сумме скоростей всех реакций, протекающих в реакционном объеме.
Производительность – изменение количества вещества в единицу времени.
Разность между конечным и начальным количеством вещества.
 2014-02-12
2014-02-12 1128
1128








