Скорость химической реакции обозначается 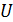 [кмольА/м³с].
[кмольА/м³с].
Рассмотрим реакцию:
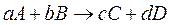
компонент А в недостатке.
Скорость оценивается по веществу, которое прореагировала, т.к. его количество уменьшается.
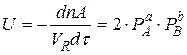
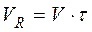
Скорость химической реакции равна изменению числа молей в единицу времени в единице объема.
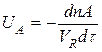
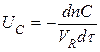
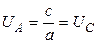
Скорость химической реакции пропорциональна движущей силе химической реакции 
Движущая сила – произведение концентраций компонентов.
В растворе: ДС= 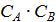
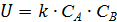 , уравнение Аррениуса.
, уравнение Аррениуса.
Формальная кинетика основывается на том, что скорость пропорциональна концентрации, а показатели будут являться коэффициентами. В истинной кинетике считается, что любая химическая реакция многостадийна.
Например:
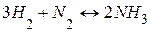

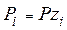
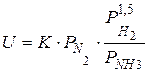
Зависимость скорости реакции от давления
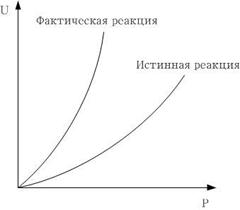
С увеличением давления скорость химической реакции тоже увеличивается.
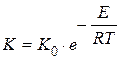 - уравнение Аррениуса.
- уравнение Аррениуса.
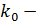 предэкспоненциальный множитель, он
предэкспоненциальный множитель, он показывает вероятность протекания химической реакции;
показывает вероятность протекания химической реакции;
[AB*]  промежуточный комплекс;
промежуточный комплекс;
Е 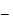 энергия активации, то есть тот избыток энергии, который необходимо преодолеть реагирующим молекулам, чтобы произошла химическая реакция, кДж/кмоль;
энергия активации, то есть тот избыток энергии, который необходимо преодолеть реагирующим молекулам, чтобы произошла химическая реакция, кДж/кмоль;
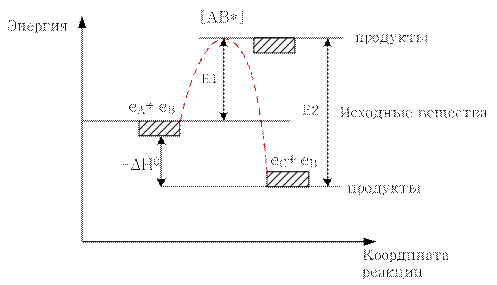
Если 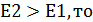 реакция экзотермическая.
реакция экзотермическая.
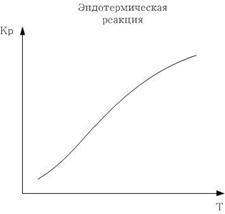
Если 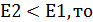 реакция эндотермическая.
реакция эндотермическая.
 2014-02-12
2014-02-12 657
657








