Статистическая интерпретация энтропии
Существую понятия макро- и микросостояний системы. Макросостояние системы характеризуется параметрами состояния (p, V, T, хим. состав). Но термодинамическая система состоит из огромного числа микрочастиц, имеющих определенную энергию, скорость, направление движения, поскольку находятся в непрерывном хаотичном движении.
При равновесии макросостояние не изменяется, т.е. макросвойства (p, V, T, хим. состав) остаются постоянными, а микросвойства (положение частицы в объеме системы, энергия, скорость ее) непрерывно меняются. Равномерное распределение молекул между отдельными частями занимаемого ими объема осуществляется лишь как среднее во времени. В каждый данный момент в результате хаотического движения молекул имеется временное увеличение концентрации молекул (микрочастиц) в одних участках объема и уменьшение ее в других. Наблюдаемое макросостояние может существовать при различных распределениях молекул, то есть оно осуществляется разными микросостояниями.
Термодинамическая вероятность W – это число микросостояний системы, с помощью которых реализуется данное макросостояние. В отличие от математической вероятности, равной отношению числа благоприятных событий к общему числу возможных событий, а поэтому всегда меньшей единицы, термодинамическая вероятность может быть очень большой величиной.
Между термодинамической вероятностью и энтропией как термодинамической функцией состояния, характеризующей стремление системы к беспорядку, существует связь, именуемая формулой Больцмана:
S = k ln W,
где k – константа Больцмана, k = 1,38×10-23 Дж/К.
Энтропия характеризует вероятность реализации системы. Чем больше энтропия, тем больше способов реализации системы. Например, энтропия возрастает при распаде молекул ВМС на отдельные фрагменты. При переходе вещества из жидкого состояния в газообразное при постоянной температуре энтропия возрастает вследствие увеличения объема пара. При нагревании вещества энтропия всегда увеличивается, так как усиливается тепловое движение молекул и возрастает беспорядок.
Формула Больцмана – краеугольный камень в термодинамике, определяет условия и возможности всех физико-химических процессов. Она выбита на надгробном камне в качестве эпитафии Больцману на центральном кладбище в Вене.
некоторых процессов
Все процессы, протекающие в природе и технике, являются необратимыми. Для необратимых процессов изменение энтропии связано с приведенной теплотой процесса неравенством:
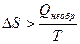 .
.
Следовательно, применяя данное неравенство, изменение энтропии при протекании необратимого процесса вычислить нельзя. Однако энтропия является функцией состояния системы, и ее изменение определяется начальным и конечным состоянием системы и не зависит от пути проведения процесса. Независимо от того, как протекает процесс: обратимо или необратимо изменение энтропии будет одинаковым. Для расчета D S при протекании реального необратимого процесса его можно мысленно разбить на несколько стадий, которые проводятся обратимо. Для каждой стадии вычисляется изменение энтропии на основе уравнения II закона термодинамики для обратимых процессов:
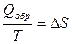
Изменение энтропии в необратимом процессе равно сумме DS всех стадий.
 2014-02-12
2014-02-12 539
539








