Равновесие в однокомпонентной двухфазной системе.
Рассмотрим двухфазную однокомпонентную систему. При равновесии в соответствии с теоремой равновесия Гиббса:
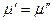 .
.
Так как состав фаз постоянен, то химический потенциал компонента зависит только от внешних параметров р и Т:
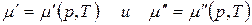 .
.
Продифференцировав, получим
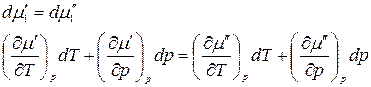 .
.
Так как химический потенциал чистого компонента – есть парциальная мольная энергия Гиббса (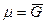 ), то
), то
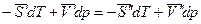 ,
,
где 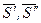 - мольная энтропия компонента в первой и второй фазах соответственно;
- мольная энтропия компонента в первой и второй фазах соответственно;
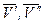 - мольный объем компонента в первой и второй фазах соответственно.
- мольный объем компонента в первой и второй фазах соответственно.
Преобразуем:
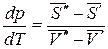 .
.
Разность 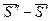 - есть изменение мольной энтропии при переходе вещества из фазы «′» в фазу «″», то есть это энтропия фазового превращения. Тогда
- есть изменение мольной энтропии при переходе вещества из фазы «′» в фазу «″», то есть это энтропия фазового превращения. Тогда
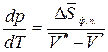
Изменение энтропии при фазовом превращении
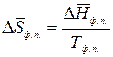 ,
,
где 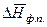 – мольная теплота фазового перехода;
– мольная теплота фазового перехода;
Тф.п. – температура фазового перехода,
следовательно,
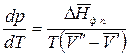 . (2.6)
. (2.6)
Полученное уравнение (2.6) – уравнение состояния однокомпонентной двухфазной системы Клаузиуса-Клапейрона.
Применим полученное уравнение к различным процессам.
В процессе плавления производная dp/dT показывает, на какую величину нужно изменить давление, чтобы изменить температуру плавления вещества на 1 градус. Для большинства веществ плотность ρ т > ρ ж, тогда 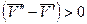 и
и 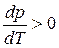 . Следовательно, с повышением давления температура плавления будет увеличиваться. Если ρ т < ρ ж, например, для воды (глицерина или висмута), то
. Следовательно, с повышением давления температура плавления будет увеличиваться. Если ρ т < ρ ж, например, для воды (глицерина или висмута), то 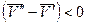 и
и 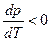 и с повышением давления температура плавления будет снижаться.
и с повышением давления температура плавления будет снижаться.
Для процесса возгонки твердого вещества или испарения жидкости можно допустить, что 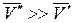 . Если паровую фазу можно считать идеальной, то в соответствии с уравнением Менделеева-Клапейрона
. Если паровую фазу можно считать идеальной, то в соответствии с уравнением Менделеева-Клапейрона
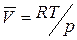 ,
,
тогда уравнение (2.6) запишется:
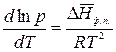 .
.
Разделив переменные и проинтегрировав в определенных пределах в узком интервале температур, считая 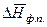 постоянной величиной, получим
постоянной величиной, получим
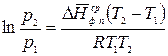 , (2.7)
, (2.7)
где 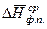 – среднее значение мольной теплоты фазового перехода в интервале температур от Т 1 до Т 2.
– среднее значение мольной теплоты фазового перехода в интервале температур от Т 1 до Т 2.
На основе полученного уравнения (2.7) можно рассчитать:
1) температуру кипения вещества Т2 под давлением р2, если известна температура кипения Т1 этого вещества под давлением р1 и величина средней мольной теплоты испарения;
2) давление насыщенного пара индивидуального вещества р2 при температуре Т2, если известно давление насыщенного пара р1 при температуре Т1 и средняя мольная теплота испарения;
3) среднюю мольную теплоту испарения или возгонки вещества, если известны значения давления насыщенного пара вещества при двух температурах.
 2014-02-12
2014-02-12 625
625








