РАСЧЕТ ЭНТРОПИИ ДЛЯ РАЗЛИЧНЫХ
ЛЕКЦИЯ 4
Все процессы, протекающие в природе и технике, являются необратимыми. Применяя неравенство (48), выражающее II закон термодинамики для необратимых процессов, нельзя вычислить изменение энтропии. Однако энтропия является функцией состояния системы, поэтому независимо от того, как протекает процесс (обратимо или необратимо), изменение энтропии будет одинаковым. Для расчета 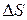 при протекании реального необратимого процесса его разбивают на несколько стадий, которые можно считать протекающими обратимо. Для каждой стадии вычисляют
при протекании реального необратимого процесса его разбивают на несколько стадий, которые можно считать протекающими обратимо. Для каждой стадии вычисляют 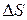 на основе уравнения II закона термодинамики для обратимых процессов (44). Изменение энтропии в необратимом процессе равно сумме
на основе уравнения II закона термодинамики для обратимых процессов (44). Изменение энтропии в необратимом процессе равно сумме 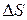 всех стадий.
всех стадий.
 1.) Расчет энтропии идеального газа и изменения энтропии при протекании процессов в идеальном газе
1.) Расчет энтропии идеального газа и изменения энтропии при протекании процессов в идеальном газе
Расчет будем вести для 1 моль, так как энтропия 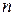 моль идеального газа равна
моль идеального газа равна 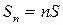 .
.
Преобразуем уравнение II закона термодинамики для обратимых процессов в идеальном газе (44):
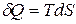 .
.
Подставим последнее уравнение в уравнение I закона термодинамики (7), получим:
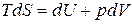 . (51)
. (51)
Из уравнения (23) для изохорной теплоемкости следует, что:
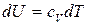 .
.
Согласно уравнению Менделеева–Клапейрона для 1 моль идеального газа:
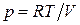 .
.
Подставим последние уравнения в уравнение (51), получим:
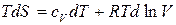 .
.
В последнем уравнении разделим левую и правую части уравнения на 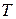 , получим:
, получим:
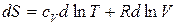 . (52)
. (52)
Проинтегрируем (52) в неопределенных пределах:
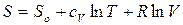 , (53)
, (53)
где 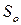 – константа интегрирования, которая имеет физический смысл энтропии идеального газа при абсолютном нуле температуры.
– константа интегрирования, которая имеет физический смысл энтропии идеального газа при абсолютном нуле температуры.
Таким образом, для расчета энтропии по уравнению (53) необходимо знать 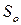 , которую можно рассчитать методами статистической термодинамики.
, которую можно рассчитать методами статистической термодинамики.
С практической точки зрения удобнее проинтегрировать (52) в определенных пределах:
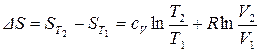 . (54)
. (54)
Выразим внутреннюю энергию идеального газа через энтальпию:
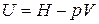 .
.
Продифференцируем уравнение
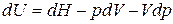 .
.
Подставим в уравнение (51) вместо 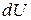 его значение. С учетом того, что согласно уравнению Менделеева–Клапейрона
его значение. С учетом того, что согласно уравнению Менделеева–Клапейрона 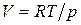 , а из уравнения (24) для изобарной теплоемкости следует, что
, а из уравнения (24) для изобарной теплоемкости следует, что 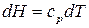 , имеем:
, имеем:
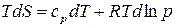 .
.
Разделив левую и правую части уравнения на 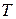 , получим:
, получим:
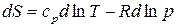 . (55)
. (55)
Проинтегрируем (55) в неопределенных пределах:
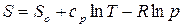 . (56)
. (56)
Проинтегрируем (55) в определенных пределах:
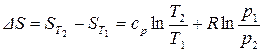 . (57)
. (57)
Если процесс в идеальном газе осуществляется при:
 : из (54) имеем:
: из (54) имеем: 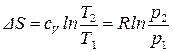 ;
;
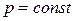 : из (57) получим:
: из (57) получим: 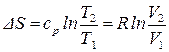 ;
;
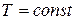 : из (54) и (57) следует:
: из (54) и (57) следует: 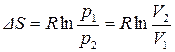 .
.
2.) Расчет энтропии при фазовых превращениях веществ
Фазовое превращение – это процесс, который связан с изменением агрегатного состояния вещества.
Отличительные особенности процессов фазовых превращений:
1. процесс может протекать равновесно (то есть обратимо);
2. процессы протекают в изотермических условиях (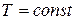 ).
).
Различают фазовые превращения:
испарение (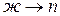 ); конденсация (
); конденсация (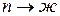 );
);
возгонка (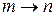 ); сублимация (
); сублимация (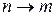 );
);
плавление (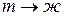 ); кристаллизация (
); кристаллизация (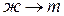 ).
).
Для процесса фазового превращения уравнение II закона термодинамики имеет вид:
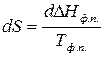 .
.
После интегрирования при 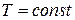 имеем:
имеем:
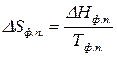 . (58)
. (58)
3.) Расчет изменения энтропии при нагревании (или охлаждении)
3.1.) Рассмотрим изобарный процесс 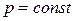 .
.
Из уравнения II закона термодинамики для обратимых процессов (44) и уравнения (24) для изобарной теплоемкости при 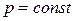 , получим:
, получим:
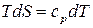 .
.
Разделим последнее уравнение на 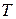 :
:
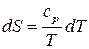 . (59)
. (59)
Запишем уравнение (59) вначале для исходного (обозначим индексом 1), а потом для конечного (2) состояния системы:
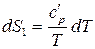 ;
; 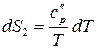 ,
,
где 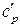 ,
, 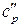 – теплоемкости системы в исходном и конечном состоянии.
– теплоемкости системы в исходном и конечном состоянии.
Последние уравнения показывают зависимость 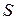 системы в исходном и конечном состоянии от температуры.
системы в исходном и конечном состоянии от температуры.
Вычтем почленно из последнего уравнения предпоследнее, получим:
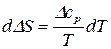 (60)
(60)
В результате интегрирования уравнения в определенных пределах, приняв за нижний предел стандартную температуру 298 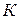 , а за верхний – произвольную температуру
, а за верхний – произвольную температуру 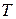 , получим:
, получим:
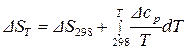 ,
,
где 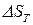 – изменение энтропии процесса при температуре
– изменение энтропии процесса при температуре 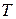 ;
;
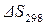 – рассчитывают на основании справочных данных о мольных энтропиях индивидуальных веществ (
– рассчитывают на основании справочных данных о мольных энтропиях индивидуальных веществ (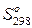 ).
).
После подстановки значения 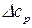 в последнее уравнение и его интегрирования, получим:
в последнее уравнение и его интегрирования, получим:
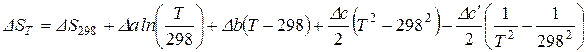 . (61)
. (61)
Для химических реакций справедливо:
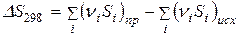 . (62)
. (62)
3.2.) Аналогично, при 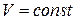 получим:
получим:
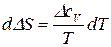 . (63)
. (63)
4.) Абсолютные значения энтропий твердых, жидких и газообразных веществ
4.1.) Абсолютное значение энтропии твердых кристаллических веществ 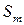
Абсолютно твердое тело – твердое тело с идеальной кристаллической решеткой
Для расчета 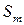 при
при 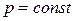 воспользуемся уравнением (59). Проинтегрируем его в неопределенных пределах, то есть от абсолютного нуля до произвольной температуры
воспользуемся уравнением (59). Проинтегрируем его в неопределенных пределах, то есть от абсолютного нуля до произвольной температуры 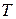 , получим:
, получим:
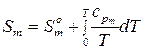 ,
,
где 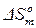 – величина энтропии абсолютно твердого тела
– величина энтропии абсолютно твердого тела 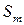 при абсолютном нуте температур.
при абсолютном нуте температур.
Постулат Макса Планка: энтропия абсолютно твердого кристаллического вещества при абсолютном нуле температур равна нулю 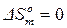 .
.
С учетом того, что 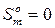 , можно рассчитать абсолютное значение энтропии твердого вещества при любой температуре по формуле:
, можно рассчитать абсолютное значение энтропии твердого вещества при любой температуре по формуле:
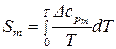 . (64)
. (64)
4.2.) Абсолютная энтропия жидкости 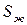
Абсолютная энтропия жидкости при охлаждении складывается из изменения энтропии при охлаждении жидкости, изменения энтропии в процессе фазового превращения (при определенной температуре начинается кристаллизация), изменения энтропии при охлаждении закристаллизовавшейся жидкости до абсолютного нуля, про абсолютном нуле 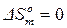 . Наоборот, если нагревать твердое тело от абсолютного нуля до температуры плавления
. Наоборот, если нагревать твердое тело от абсолютного нуля до температуры плавления 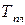 рост энтропии составит
рост энтропии составит 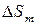 , при
, при 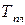 осуществится фазовое превращение (плавление), которому соответствует возрастание энтропии
осуществится фазовое превращение (плавление), которому соответствует возрастание энтропии 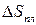 , а нагреванию жидкости до заданной температуры
, а нагреванию жидкости до заданной температуры 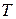 будет отвечать изменение энтропии
будет отвечать изменение энтропии 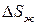 . Следовательно,
. Следовательно,
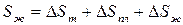 .
.
Все слагаемые могут быть рассчитаны:
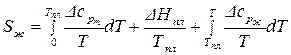 . (65)
. (65)
4.3.) Абсолютная энтропия газообразного вещества
Аналогично рассуждая, получим:
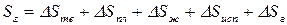 ,
,
где 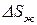 – изменение энтропии жидкости при ее нагревании от
– изменение энтропии жидкости при ее нагревании от 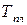 до
до 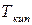 ;
;
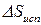 – возрастание энтропии при испарении при
– возрастание энтропии при испарении при 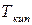 ;
;
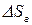 – увеличение энтропии газа при его нагревании от
– увеличение энтропии газа при его нагревании от 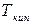 до произвольной температуры
до произвольной температуры 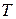 .
.
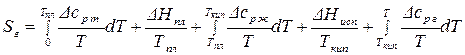 . (66)
. (66)
Абсолютные значения энтропии при стандартных условиях приведены в справочниках.
 2014-02-12
2014-02-12 3232
3232
