ЛЕКЦИЯ 6
Выражения I закона термодинамики справедливы при условии неизменности количеств составляющих систему веществ. Количество взаимодействующих веществ и продуктов реакции определяется числом моль 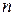 . В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются все характеристические функции.
. В результате физико-химических процессов, связанных с изменением количеств участвующих в процессе веществ (химических реакции, фазовых переходов), изменяются все характеристические функции.
Для 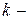 компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
компонентной системы, с учетом изменения числа моль компонентов, участвующих в физико-химическом процессе, уравнение (83) для изменения энергии Гиббса примет вид:
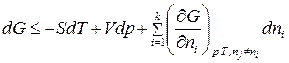 . (86)
. (86)
В (86) знак «неравенства» относится к самопроизвольному процессу, а знак «равенства» – к равновесному. Частная производная от энергии Гиббса (или любой другой из характеристических функций (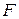 ,
, 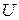 ,
, 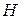 )) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния – это химический потенциал
)) по изменению числа моль одного из компонентов при неизменности чисел моль остальных компонентов и соответствующих параметров состояния – это химический потенциал 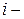 го компонента
го компонента 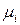 .
.
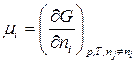 . (87)
. (87)
С учетом (87) получим:
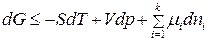 . (88)
. (88)
Химический потенциал можно выразить через частные производные и других термодинамических потенциалов
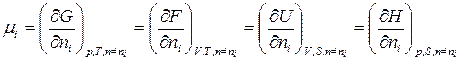 (89)
(89)
и аналогично уравнению (86) выразить энергию Гельмгольца 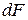 ,
, 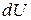 ,
, 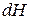 .
.
Химический потенциал размерная величина – 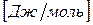 .
.
Химический потенциал имеет физический смысл парциальной мольной работы при изменении числа моль данного компонента на единицу при постоянных внешних параметрах и числах моль всех других компонентов, составляющих раствор.
Для изобарно-изотермических условий, когда 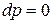 и
и 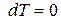 , из (88) при равновесии имеем:
, из (88) при равновесии имеем:
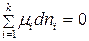 . (90)
. (90)
Для однокомпонентной системы из (87), получим:
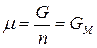 , (91)
, (91)
где 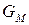 – мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
– мольная энергия Гиббса компонента (индивидуального вещества) или мольный термодинамический потенциал.
Таким образом, химический потенциал индивидуального компонента тождественен мольной энергии Гиббса.
 2014-02-12
2014-02-12 2301
2301