Распределение вещества между двумя
ЛЕКЦИЯ 12
растворителями (Закон распределения Нернста)
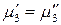 .
.
Выразим химический потенциал третьего компонента в обеих жидких фазах через его термодинамическую активность:
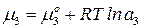 .
.
Подставим значение химического потенциала:
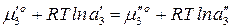
где 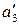 ,
, 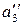 – термодинамическая активность третьего компонента в соответствующих растворителях.
– термодинамическая активность третьего компонента в соответствующих растворителях.
Преобразуем:
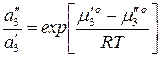 .
.
В правой части имеем величину, постоянную при постоянной температуре. Обозначим ее через 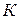 , получим
, получим
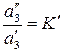 , (156)
, (156)
где 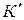 – коэффициент распределения вещества между несмешивающимися растворителями.
– коэффициент распределения вещества между несмешивающимися растворителями. 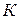 зависит от температуры и природы участников процесса.
зависит от температуры и природы участников процесса.
Если количество добавленного третьего компонента мало по сравнению с массами фаз, т.е. при распределении образуются разбавленные растворы, то термодинамические активности можно заменить концентрациями, тогда получим:
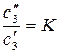 . (157)
. (157)
Уравнение (157) выражает закон распределения Нернста: для разбавленных растворов отношение равновесных концентраций распределяемого вещества в обеих фазах есть величина постоянная при постоянной температуре.
Концентрация 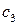 может быть моляльной, молярной или мольной долей. В зависимости от способа выражения концентрации
может быть моляльной, молярной или мольной долей. В зависимости от способа выражения концентрации 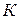 будет меняться.
будет меняться.
Если распределяемое вещество в одном из растворителей подвергается ассоциации или диссоциации, закон распределения плохо описывает опытные данные. Тогда (157) усложняют:
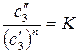 . (158)
. (158)
где 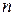 – показатель, учитывающий явления диссоциации и ассоциации распределяемого вещества в растворителях.
– показатель, учитывающий явления диссоциации и ассоциации распределяемого вещества в растворителях.
В отличие от уравнений (157) и (158), уравнение (156) универсально, так как все отклонения от свойств идеальных растворов (в том числе диссоциацию или ассоциацию молекул распределяемого вещества) формально учитывают коэффициенты активности.
Закон распределения Нернста является основой для расчета разделения жидких смесей методом жидкостной экстракции.
 2014-02-12
2014-02-12 623
623








