(ЗАКОН ШРЕДЕРА)
Изменение давления практически не влияет на равновесие в конденсированных системах, поэтому примем, что 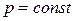 . Влияние температуры на растворимость малорастворимых в жидкости твердых веществ при равновесии кристаллов твердого вещества и раствора этого вещества в жидком растворителе выражает уравнение Шредера:
. Влияние температуры на растворимость малорастворимых в жидкости твердых веществ при равновесии кристаллов твердого вещества и раствора этого вещества в жидком растворителе выражает уравнение Шредера:
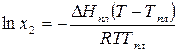 . (162)
. (162)
где 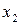 – мольная доля малорастворимого вещества в растворе (растворимость);
– мольная доля малорастворимого вещества в растворе (растворимость);
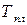 – температура плавления.
– температура плавления.
Из анализа уравнения Шредера следует:
1. с повышением температуры растворимость твердых веществ возрастает;
2. легкоплавкие вещества растворяются лучше тугоплавких.
Уравнение Шредера позволяет рассчитать растворимость только малорастворимых веществ, поскольку в этом случае мольную теплоту растворения 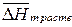 можно заменить теплотой плавления
можно заменить теплотой плавления 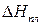 .
.
Если вещество хорошо растворимо, то молекулы растворенного вещества сольватированы, а теплота растворения складывается из теплоты плавления и мольной теплоты сольватации 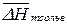 :
:
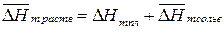 , (163)
, (163)
Теплота плавления 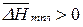 (т.к. при плавлении теплота переходит от окружающей среды к системе), а теплота сольватации
(т.к. при плавлении теплота переходит от окружающей среды к системе), а теплота сольватации 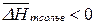 (все молекулы в растворе находятся в движении и обладают определенной кинетической энергией. При сольватации молекулы растворителя входят в сольватную оболочку растворенного вещества и движутся вместе с ними, а энергия этих молекул выделяется во внешнюю среду). Поэтому, для хорошо растворимых веществ влияние температуры на растворимость будет определять соотношение слагаемых в (165):
(все молекулы в растворе находятся в движении и обладают определенной кинетической энергией. При сольватации молекулы растворителя входят в сольватную оболочку растворенного вещества и движутся вместе с ними, а энергия этих молекул выделяется во внешнюю среду). Поэтому, для хорошо растворимых веществ влияние температуры на растворимость будет определять соотношение слагаемых в (165):
если 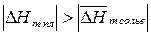 , то с повышением температуры растворимость веществ будет увеличиваться (например, сахароза);
, то с повышением температуры растворимость веществ будет увеличиваться (например, сахароза);
если 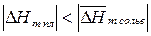 , то с повышением температуры растворимость веществ будет снижаться (например,
, то с повышением температуры растворимость веществ будет снижаться (например, 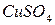 ).
).
Шредер рассматривал случай, когда 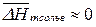 , допуская, что при растворении малорастворимого вещества его молекулы не сольватированы.
, допуская, что при растворении малорастворимого вещества его молекулы не сольватированы.
 2014-02-12
2014-02-12 2251
2251
