ЛЕКЦИЯ 11
А. ФАЗОВОЕ равновесие жидкость – пар
Пусть существуют в состоянии термодинамического равновесия идеальный жидкий раствор (′) и выделяющийся из него идеальный пар (″). В соответствии с теоремой равновесия Гиббса химический потенциал любого компонента в системе одинаков во всех фазах:
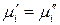 .
.
Тогда, выразив химический потенциал 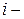 го компонента в жидкой фазе через мольную долю, а в паровой фазе – через парциальное давление, получим:
го компонента в жидкой фазе через мольную долю, а в паровой фазе – через парциальное давление, получим:
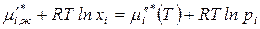 .
.
Преобразуем уравнение:
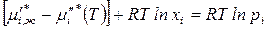 .
.
Значение функции температуры, заключенной в скобки, найдем из граничного условия: если 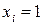 (т.е. и жидкий раствор и паровая фаза состоят только из
(т.е. и жидкий раствор и паровая фаза состоят только из 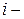 го компонента), то
го компонента), то 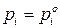 .
.
Следовательно, из последнего уравнения получаем
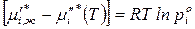 ,
,
где 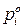 – давление насыщенного пара индивидуального
– давление насыщенного пара индивидуального 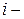 го компонента при температуре раствора.
го компонента при температуре раствора.
Подставим в уравнение вместо выражения в скобках его значение:
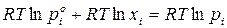 .
.
Откуда
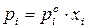 , (153)
, (153)
где 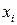 – мольная доля
– мольная доля 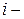 го компонента в жидкости.
го компонента в жидкости.
Уравнение (153) выражает закон Рауля – основной закон идеальных жидких растворов.
Для двухкомпонентного идеального раствора (153) можно записать:
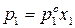 ;
;
 .
.
Так как 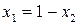 , а общее давление над раствором складывается из парциальных давлений компонентов
, а общее давление над раствором складывается из парциальных давлений компонентов 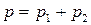 , то
, то
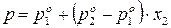 .
.
Таким образом, зависимость давления насыщенного пара компонентов и общего давления пара от состава идеального раствора  является линейной (рис. 12).
является линейной (рис. 12).
На практике чаще приходится встречаться с реальными растворами, которые не подчиняются закону Рауля. Для описания зависимости давления насыщенного пара компонента от состава реального раствора в закон Рауля (153) вводят коэффициенты активности компонентов:
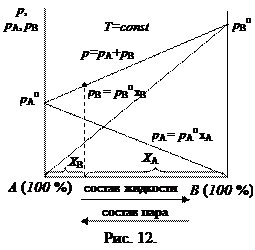
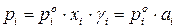 . (154)
. (154)
Для реального двухкомпонентного раствора общее давление смеси равно:
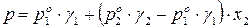 .
.
Поскольку коэффициенты активности 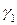 и
и 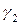 зависят от состава раствора, то зависимость
зависят от состава раствора, то зависимость 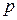 от
от 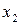 должна быть криволинейной (рис. 13).
должна быть криволинейной (рис. 13).

Отклонения давления пара от линейной зависимости в сторону больших значений называют положительными, а в сторону меньших – отрицательными отклонениями от закона Рауля. Отклонения зависят от относительной величины энергии взаимодействия молекул жидкой смеси: если энергия взаимодействия между молекулами разных компонентов больше, чем между молекулами одного и того же вещества, то на кривой давления пара наблюдаются отрицательные отклонения. В противоположном случае наблюдаются положительные отклонения.
 Иногда отклонения бывают настолько велики, что на кривых давление (температура) – состав появляется ярко выраженный экстремум (минимум или максимум).
Иногда отклонения бывают настолько велики, что на кривых давление (температура) – состав появляется ярко выраженный экстремум (минимум или максимум).
Точки на диаграммах 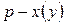 и
и 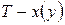 , которым отвечает максимум давления насыщенного пара (минимум температуры кипения) называют положи-тельными (рис. 14 а), а если минимум давления (максимум температуры кипения) – отрицательными азеотропами (рис. 14 б).
, которым отвечает максимум давления насыщенного пара (минимум температуры кипения) называют положи-тельными (рис. 14 а), а если минимум давления (максимум температуры кипения) – отрицательными азеотропами (рис. 14 б).
Как видно из рис. 14, в точке азеотропа состав жидкой и паровой фаз одинаков. Бинарные смеси, которые содержат азеотроп, называют азеотропными.
Состав равновесного с жидким раствором пара определяют согласно закону Дальтона. Если поделить левую и правую части уравнений (153) и (154) на общее давление системы, получим:
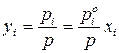 – для идеального раствора;
– для идеального раствора;
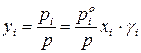 – для реального раствора.
– для реального раствора.
где 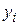 – мольная доля
– мольная доля 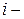 го компонента в равновесном паре.
го компонента в равновесном паре.
Из анализа последних уравнений видно, что рассчитать равновесный состав пара можно только для идеального раствора заданного состава. Для расчета равновесного состава паровой фазы реального раствора необходимо знать коэффициенты активности, численные значения которых определяют только экспериментальным путем.
Разделив полученные уравнения на 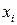 , получим:
, получим:
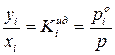 и
и 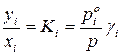 ,
,
где 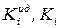 – коэффициенты летучести
– коэффициенты летучести 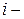 го компонента в идеальной и реальной летучей смеси. Чем больше
го компонента в идеальной и реальной летучей смеси. Чем больше 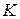 для данного компонента, тем более летуче вещество.
для данного компонента, тем более летуче вещество.

Для представления данных по фазовому равновесию жидкость – пар рассмотрим 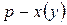 ,
, 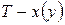 ,
, 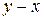 диаграммы (рис. 15), на которых точка
диаграммы (рис. 15), на которых точка 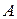 отвечает чистому компоненту
отвечает чистому компоненту 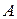 (100 %), точка
(100 %), точка 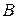 – чистому компоненту
– чистому компоненту 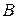 (100 %);
(100 %);
1 – кривая зависимости давления насыщенного пара (температуры кипения) от состава пара; 2 – кривая зависимости давления насыщенного пара (температуры кипения) от состава жидкости. Область ниже (выше) кривой состава пара отвечает состоянию гомогенной системы – пара; область выше (ниже) кривой состава жидкости отвечает состоянию жидкости. Область, лежащая между кривыми 1 и 2, отвечает состоянию гетерогенной системы жидкость – пар, любая точка внутри которой характеризует состояние равновесия между жидкостью и паром.
Например, на диаграмме 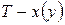 в точке
в точке 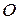 при температуре
при температуре 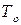 находится гетерогенная система, состоящая из жидкости и пара, общий состав которой
находится гетерогенная система, состоящая из жидкости и пара, общий состав которой 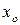 компонента
компонента 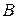 . Если через точку
. Если через точку 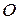 провести изотерму до пересечения с линиями жидкости и пара и из точек пересечения
провести изотерму до пересечения с линиями жидкости и пара и из точек пересечения 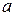 и
и 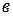 опустить перпендикуляры на ось состава, то полученные точки будут выражать составы жидкости
опустить перпендикуляры на ось состава, то полученные точки будут выражать составы жидкости 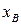 и пара
и пара 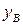 , находящихся в равновесии при данных условиях. Если известна масса
, находящихся в равновесии при данных условиях. Если известна масса 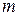 гетерогенной смеси в точке
гетерогенной смеси в точке 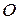 , то по правилу рычага можно рассчитать равновесные массовые соотношения фаз:
, то по правилу рычага можно рассчитать равновесные массовые соотношения фаз:
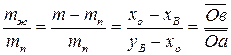 ,
,
где 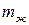 ,
, 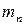 – масса жидкой и паровой фазы;
– масса жидкой и паровой фазы;
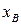 ,
, 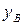 – мольная доля компонента
– мольная доля компонента 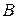 в жидкости и равновесном паре.
в жидкости и равновесном паре.
Для разделения жидких бинарных смесей используют методы перегонки и ректификации (многократной перегонки), которые основаны на различие составов жидкой и паровой фаз. Азеотропные смеси этими методами разделить невозможно. Для разделения азеотропных смесей необходимо создать условия, устраняющие азеотроп. Например, изменить значения внешних параметров (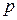 ,
, 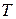 ) или добавить к бинарной смеси третий компонент, в присутствии которого азеотроп отсутствует.
) или добавить к бинарной смеси третий компонент, в присутствии которого азеотроп отсутствует.
 2014-02-12
2014-02-12 777
777








