Скорость химической реакции – это изменение концентрации (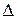 C) реагирующих веществ за единицу времени(
C) реагирующих веществ за единицу времени(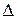 t)
t)
Vср = ±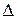 с/
с/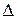 t.
t.
Знак «+» ставится, если скорость контролируется по образующемуся продукту, а знак «–» — по расходу исходного вещества.
 По результатам измерений концентраций во времени строят так называемые кинетические кривые.
По результатам измерений концентраций во времени строят так называемые кинетические кривые.
Например, в ходе реакции А ® В концентрация исходного вещества А уменьшается, а продукта реакции В – увеличивается и кинетическая кривая имеет вид(рисунок 1).
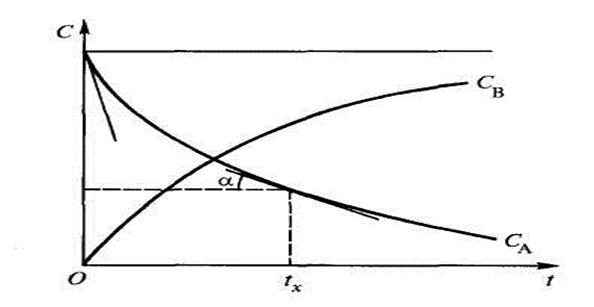
Рисунок 1 Кинетические кривые расходования исходного вещества А и образования продукта реакции В
В зависимости от количества фаз все системы и протекающие в них реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе. Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода, является гомогенной так как все вещества находятся в газообразном состоянии
Cl2(г) + H2(г) = 2HCl(г).
Гетерогенные реакции протекают на поверхности раздела фаз. Примером гетерогенной реакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз)
С(к) + О2(г) = СО2(г).
2 Факторы, влияющие на скорость химических реакций
Основные факторы, влияющие на скорость реакции:
1) Природа реагирующих веществ,
2) Концентрация реагирующих веществ,
3) Температура,
4) Наличие посторонних веществ.
2.1 Природа реагирующих веществ
С увеличением концентрации скорость реакции возрастает, так как чаще происходят столкновения молекул реагирующих веществ. Количественно эта зависимость определяется законом действующих масс.
Закон действующих масс (1867г.) — скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для гомогенной реакции mА + пВ = С
уравнение скорости реакции имеет вид

Входящая в уравнение константа скорости К — это скорость реакции при концентрациях реагирующих веществ равных единице.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Напишем выражение закона действующих масс для следующих реакций:
1) N2(г) + 3H2(г) = 2NH3(г);
2) 2C(к) + O2(г) = 2CO(г).
Решение
1) Данная система являться гомогенной, поэтому в формулу закона действующих масс будут входить концентрации всех компонентов:
u=[N2]·[H2]3;
2) Данная система являться гетерогенной, поэтому в формулу закона действующих масс будут входить концентрации только газообразных веществ
u=[О2].
2.2 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса
 2014-02-12
2014-02-12 380
380








