МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Это связь между катионами металла и электронным «газом».
Благодаря данной связи металлы обладают:
высокими температурами плавления, высокой тепло- и электропроводностью, высокой прочностью, способностью отражать свет, пластичностью, ковкостью и др. свойствами.
Валентные электроны металлов слабо связаны со своими ядрами и могут легко отрываться. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны (электронный газ), электростатическое взаимодействие которых приводит к металлической связи.
Атом водорода, связанный с высоко электроотрицательным элементом (фтором, кислородом, азотом и др.), способен образовывать еще одну химическую связь. Например, водородная связь между молекулами: 1)воды, 2) уксусной кислоты
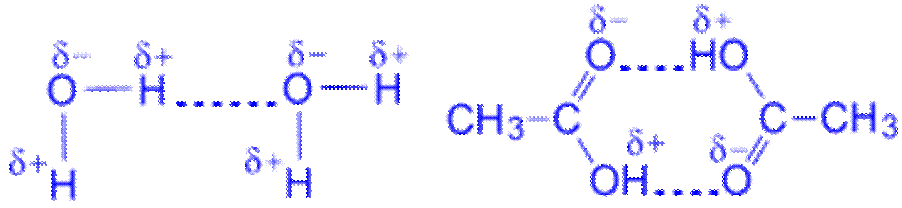
Эта связь значительно слабее других химических связей (энергия ее образования 10–40 кДж/моль.
Исключительно важную роль водородная связь играет в таких неорганических веществах как вода, плавиковая кислота, аммиак и т.д., а также в биологических макромолекулах.
В растворах могут возникать длинные цепи ассоциатов вида:
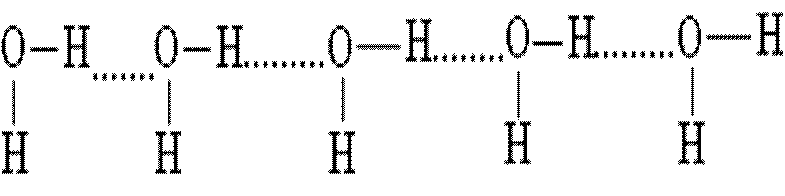
Наличие водородных связей объясняет аномально высокие температуры плавления и кипения воды. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы.
 2014-02-12
2014-02-12 582
582








