Если атом образует несколько связей, с участием различных орбиталей, то может происходить такое явление как гибридизация атомных орбиталей. Гибридизация – это выравнивание формы и энергии различных орбиталей при образовании ковалентной связи.
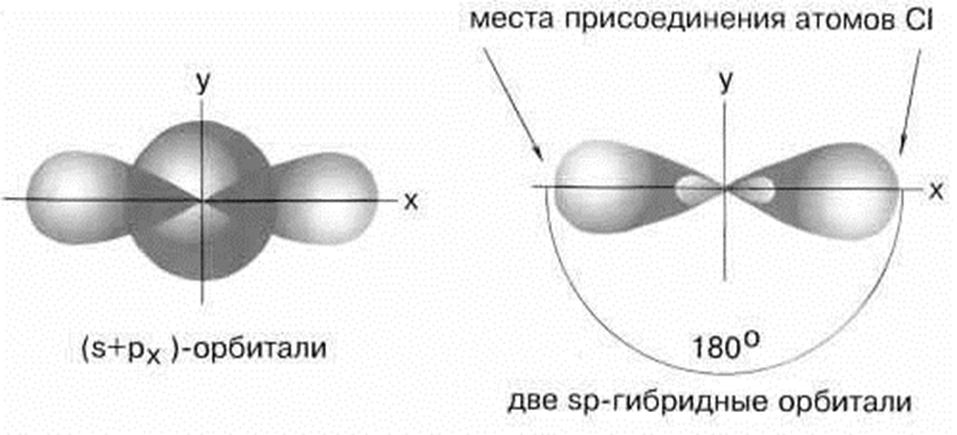 5.1. Строение ВеСl2. sp – гибридизация
5.1. Строение ВеСl2. sp – гибридизация
Рисунок 3. sp – гибридизация
Молекула BeCl2 имеет линейную форму, а обе связи Be–Cl совершенно одинаковы.
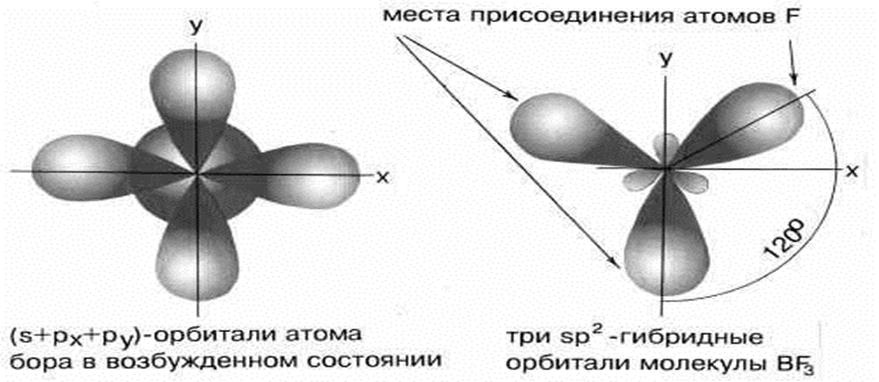
5.2. Строение ВF3. sp2 –гибридизация
5.2. Строение молекулы СН4. sp3 –гибридизация
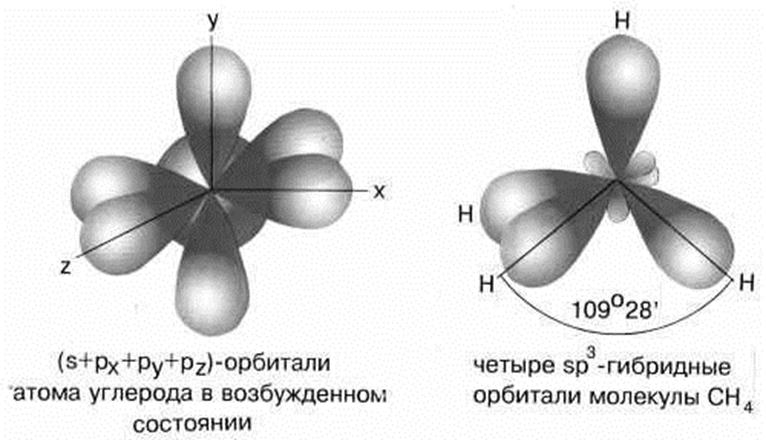
Молекула метана имеет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
 2014-02-12
2014-02-12 700
700








