Строение вещества. Типы кристаллических решеток
Кристаллическая структура характеризуется правильным (регулярным) расположением частиц в кристалле. В зависимости от того, какой тип взаимодействия осуществляется между частицами, различают четыре типа кристаллических решеток: атомная, ионная, металлическая и молекулярная.
6.1. Атомная кристаллическая решётка
Построена из атомов, соединенных ковалентной связью. Поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью. Например, углерод (алмаз и графит) карборунд SiC, бор.
6.2. Ионная кристаллическая решётка
Состоит из положительных и отрицательных ионов. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, NaCl tпл. = 801 °C).
В узлах кристаллической решётки металла находятся катионы металла, а в межатомном пространстве свободные электроны, элекростатическое взаимодействие которых приводит к х имической связи. При этом валентные электроны способны свободно перемещаться в объёме кристалла. Образованную подобным образом химическую связь называют металлической.
6.4. Молекулярная кристаллическая решётка. Межмолекулярные взаимодействия
Молекулярная кристаллическая решетка состоит из валентнонасыщенных неполярных или слабополярных молекул или молекул инертных газов. Силы взаимодействия между молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, поэтому такие вещества плавятся при довольно низких температурах. Например, метан СН4, диоксид углерода СО2 и т. д.
В 1873 г. Голландский ученый Ван-дер-Ваальс объяснил природу сил, обуславливающих притяжение между отдельными молекулами. Эти межмолекулярные силы позднее получили название ван-дер-ваальсовых сил. Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж/∙моль.
Межмолекулярные взаимодействия делятся на:
1) Ориентационные (диполь-диполь или ион-диполь)- возникают между полярными молекулами или между ионами и полярными молекулами. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 4).
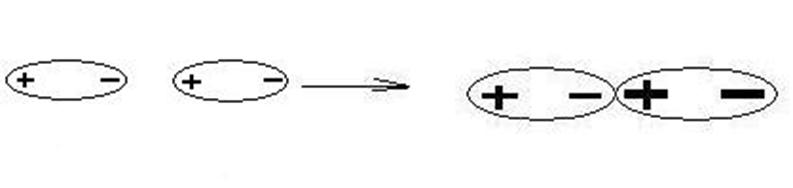
Рисунок 4 Ориентационное взаимодействие.
2) Индукционные (диполь – индуцированный диполь или ион– индуцированный диполь)- возникают между полярными молекулами или ионами и неполярными молекулами, но способными к поляризации. Диполи могут воздействовать на неполярные молекулы, превращая их в индицированные (наведенные) диполи. (рисунок 5).
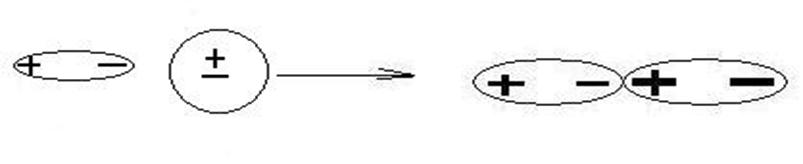
Рисунок 5. Индукционное взаимодействие.
3) Дисперсионные (индуцированный диполь – индуцированный диполь)- возникают между неполярными молекулами, но способными к поляризации. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается (рисунок 6).
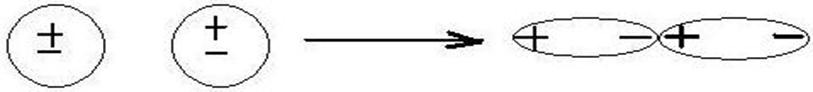 Рисунок 6. Дисперсионное взаимодействие.
Рисунок 6. Дисперсионное взаимодействие.
ТЕМА 7
ХИМИЯ ЭЛЕМЕНТОВ
ЛЕКЦИЯ № 16
«СВОЙСТВА S-ЭЛЕМЕНТОВ»
 2014-02-12
2014-02-12 1037
1037