Кристаллическими называют тела, в которых атомы и молекулы расположены в правильном геометрическом порядке, а аморфными - в которых атомы и молекулы расположены беспорядочно. С энергетической стороны имеет место принципиальное различие между кристаллическими и аморфными телами, состоящее в том, что процесс плавления и затвердевания кристаллических тел сопровождается определенным тепловым эффектом. У аморфных же тел этого теплового эффекта нет.
Характерные свойства кристаллических веществ:
а) однородность строения (однородностью кристалла назовём одинаковость узора взаимного расположения атомов во всех частях его объема);
б) анизотропия (в изотропных телах все свойства — теплопроводность, электропроводность, твёрдость царапания и т.д. — одинаковы в любом направлении, а в анизотропных телах все свойства неодинаковы в непараллельных направлениях, т.е., например, в одном направлении электрический ток проходит быстрее, в другом — медленнее);
в) симметричность.
Различие в строении кристаллических и аморфных веществ определяет и различие в их свойствах. Так, аморфные вещества, обладая большим запасом свободной энергии, химически более активны, чем кристаллические вещества такого же состава.
Стекло или стеклообразным сплавом называют неорганический или органический продукт плавления, охлажденный до твердого состояния без кристаллизации. Другими словами, стекло – это переохлажденная жидкость.
В аморфных и стеклообразных сплавах при отсутствии дальнего порядка сохраняется ближний порядок – группировки атомных частиц, отражающих химический состав вещества. Такие группировки принято называть структурными единицами. Характерным свойством стеклообразных материалов является их прозрачность в различных областях спектра. Существуют разные разновидности стекол.
Оксидные стекла (например, оконное стекло) получены на основе Na2O СаО 6SiО2 + силикаты калия, свинца (хрусталь) + оксид бора (термостойкое химическое стекло), прозрачны в видимой области спектра. Непрозрачны для ультрафиолетовых лучей.
Халькогенидные стекла (на основе халькогенов – серы, селена, теллура), прозрачные в видимой и ИК-областях спектра. Из них изготавливают приборы ночного видения, ключевые элементы памяти, используют для записи информации (в аппаратах для ксерокопирования), в голографии, для передачи изображения на дальние расстояния и в космическом пространстве, используют в качестве волноводов - волоконно-оптический кабель, термометров сопротивления для атомных реакторов.
Фторцирконатные стекла изготавливают на основе фторидов гафния, циркония с добавками других фторидов, имеют большой диапазон прозрачности - от УФ до ближней ИК области спектра.
Фосфатные стекла изготавливают на основе ортофосфата кальция – прозрачны в видимой и УФ-областях спектра (темные стекла на автомобилях).
Аллотропия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы). Если какой-либо элемент может существовать в двух или нескольких твердых формах (кристаллических либо аморфных), то считается, что он проявляет аллотропию. Различные формы одного элемента называются аллотропами. Аллотропы существуют приблизительно у половины всех элементов.
Например, углерод существует в виде алмаза либо графита. Сера существует в двух кристаллических формах-ромбической и моноклинной-в зависимости от температуры. Обе ее кристаллические формы являются примерами молекулярных кристаллов. Молекулы в них представляют собой гофрированные циклы, в каждом из которых содержится по восемь ковалентно связанных атомов серы. Твердая сера может существовать еще в третьей аллотропной форме-как пластическая сера. Эта форма серы неустойчива. Она состоит из длинных цепочек атомов серы, которые при комнатной температуре разрушаются и снова образуют молекулы S8, кристаллизующиеся в ромбическую решетку.
Фосфор может существовать в трех аллотропных формах. Наиболее устойчивая из них-красный фосфор. Красный фосфор имеет каркасную кристаллическую структуру, в которой каждый атом ковалентно связан с тремя другими атомами фосфора. Белый фосфор представляет собой молекулярный кристалл. Каждая его молекула содержит четыре атома фосфора, ковалентно связанных в тетраэдрическую структуру. Третий аллотроп - черный фосфор-образуется только при высоких давлениях. Он существует в виде макромолекулярной слоистой структуры.
Полиморфизм - это исключительное явление, присущее только твёрдому агрегатному состоянию вещества, в частности, веществам кристаллической структуры.
Суть этого явления заключается в том, что под влиянием тех или иных процессов некоторые вещества способны изменять свою кристаллическую форму при сохранении химической природы, т.е. химического состава и молекулярного строения.
Это явление наблюдается как у элементов (например, углерода, серы, кремния, железа и т.д.), так и у соединений (например, льда, кремнезёма, рутила, углекислого кальция и т.д.).
С физической точки зрения превращение кристаллического вещества из одной формы в другую обуславливается внутренней перегруппировкой молекул, которая ведёт к изменению его кристаллической структуры и свойств. Так как перемещение молекул в твёрдом теле возможно только при условии сообщения им некоторой подвижности, то процесс перехода вещества из одной модификации в другую осуществляется под действием двух факторов: давления и температуры. Из этого следует, что каждая модификация существует при строго определенных условиях (параметрах), и совместное их существование одновременно невозможно, кроме как в точке пересечения кривых упругости их паров и температур, т. е. в точке превращения.
Фуллерены — это недавно открытая форма углерода, отличная от известных ранее графита и алмаза.
Наиболее распространенным среди фуллеренов является фуллерен С60, который представляет из себя молекулу из 60 атомов углерода, образующих замкнутую сферическую поверхность, составленную из правильных шести- и пятиугольников, — молекулярный аналог европейского футбольного мяча. Фуллерены - аллотропные молекулярные формы углерода, в к-рых атомы расположены в вершинах правильных шести- и пятиугольников, покрывающих поверхность сферы или сфероида. Такие молекулы могут содержать 28, 32, 50, 60, 70, 76 и т. д. атомов С.
Главной особенностью фуллеренов является их повышенная реакционная активность. Они легко захватывают атомы других веществ и образуют материалы с принципиально новыми свойствами. На их основе возникла новая стереохимия углеродов, позволяющая целенаправленно создавать новые органические молекулы и, следовательно, вещества с заданными формами и свойствами. Фуллерены могут быть использованы как “нанокирпичики” для конструирования материалов с заданными параметрами.
Перечень основных областей применения фуллеренов:
Новые классы сверхпроводников, полупроводников, магнетиков, сегнетоэлектриков, нелинейных Новые фуллереновые технологии синтеза алмазов и алмазоподобных соединений сверхвысокой твердости.
Новые классы полимеров с заданными механическими, оптическими, электрическими, магнитными свойствами для записи и хранения информации.
Новые типы катализаторов и сенсоров для определения состава жидких и газовых сред.
Новые классы антифрикционных покрытий и смазок, в том числе, на основе фторсодержащих соединений фуллеренов. Новые виды топлив и добавок к топливам. Капсулы для безопасного захоронения радиоактивных отходов. Новые классы соединений для фармакологии и медицины, в том числе, противовирусные и нейротропные препараты, сорбенты для гемосорбции.
Фуллерены - это "химически стабильные замкнутые поверхностные структуры углерода, в которых атомы углерода расположены в вершинах правильных шестиугольников или пятиугольников, регулярным образом покрывающих поверхность сферы или сфероида".
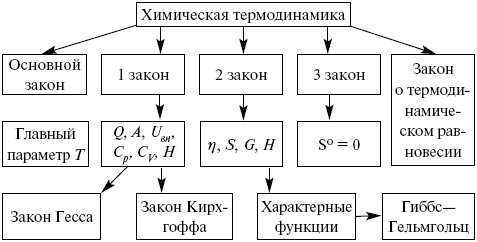
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы. В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2) фазовые равновесия для индивидуальных веществ и смесей;
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
- Реакция должна протекать либо при постоянном объёме Q v (изохорный процесс), либо при постоянном давлении Q p (изобарный процесс).
- В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции Δ H rO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моль вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции: С(тв) + 2H2(г) = CH4(г) + 74.9 кДж/моль.
Реакции, при которых теплота выделяется (энтальпия уменьшается), называются экзотермическими. Реакции, при которых теплота поглощается (энтальпия растет), называются эндотермическими. Обычно экзотермическими являются те реакции, при которых продукты обладают более прочными химическими связями, чем исходные вещества, а эндотермические — наоборот.
уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями. Помимо теплового эффекта, в термохимических уравнениях часто указывается также фазовое состояние и полиморфная модификация веществ.
Если имеется несколько реакций, итоговый тепловой эффект рассчитывают по закону Гесса.
 2015-01-30
2015-01-30 17040
17040