Химической кинетикой называется учение о скорости химических реакций и ее зависимости от различных факторов – природы и концентрации реагирующих веществ, давления, температуры, катализаторов. Скорости химических реакций могут значительно различаться. Например, некоторые реакции совершаются в тысячные доли секунды (взрыв), другие же протекают в течение значительно более длительного времени. Так, ржавчина на железе становится заметна уже через несколько часов после того, как оно пришло в контакт с водой или влажным воздухом, а процессы в земной коре протекает в течение сотен и тысяч лет.
Вопрос о скорости химических реакций имеет исключительно большое практическое и теоретическое значение. От скорости реакции в различных технологических процессах зависят производительность и габариты заводской аппаратуры, течение тех или иных биологических процессов, эффективность действия на живой организм различных лекарственных препаратов. О скорости химической реакции судят по изменению концентрации реагирующих веществ в единицу времени. При этом совершенно безразлично изменение концентрации каких веществ – исходных или продуктов – учитывается, поскольку с какой скоростью расходуются исходные вещества, с той же скоростью и накапливаются продукты реакции.
Различают два вида скоростей: среднюю и истинную. Средняя скорость представляет собой отношения изменения концентрации к промежутку времени:
uср 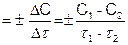 (5.1)
(5.1)
где С1 и С2 – концентрации вещества в начальный (t1) и конечный (t2) момент времени.
Истинная скорость – это скорость химической реакции в данный момент времени и представляет собой первую производную концентрации по времени:
u = 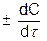 (5.6)
(5.6)
Скорость всегда положительна, знак ± относится к изменению концентрации, если концентрация в ходе процесса увеличивается, то знак «+», а если уменьшается то знак «−».
За скоростью процесса можно следить по изменению концентрации хотя бы одного из реагентов, учитывая его стехиометрический коэффициент. Для реакции вида
аA + вB → сC + d D
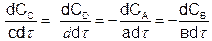 (5.3)
(5.3)
Например, для реакции
СН4 + 2Н2О = СО2+4Н2
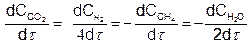
Как видно, концентрация Н2О изменяется в 2 раза, а концентрация Н2 – в 4 раза быстрее, чем концентрации СН4 и СО2.
Таким образом, чтобы получить в единицу времени наибольшее количество вырабатываемого продукта, необходимо максимальное увеличение скоростей реакций, лежащих в основе того или иного химического процесса, с другой стороны, нежелательные процессы (коррозию металлов, окисление каучука) необходимо как можно больше замедлить. Поэтому изучение законов химической кинетики открывает путь к сознательному регулированию скоростей реакций. Управление химическим процессом является главной задачей химической кинетики.
 2014-02-12
2014-02-12 1072
1072
