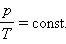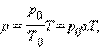1) Изохорный процесс (рис.1) - это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
|
V = const, V 2 = V 1.
Уравнение состояния процесса:
P2 / P1 = T2 / T1.
Так как V 2 = V 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
q = Du = = сv·(t2 - t1);

Количество теплоты, подведенное в изохорном процессе, равно изменению внутренней энергии. Для произвольной массы вещества:
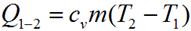 .
.
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 1.2).
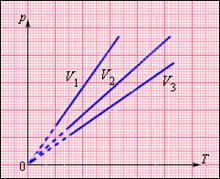 |
| Рисунок 1.2 - Семейство изохор на плоскости (p, T). V 3 > V 2 > V 1 |
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
|
|
|
Уравнение изохорного процесса может быть записано в виде:
|
где p 0 – давление газа при T = T 0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
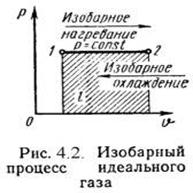
2) Изобарный процесс (рис. 2) - квазистатический процесс, протекающий при неизменным давлении p.
P = сonst, P2 = P1
Уравнение состояния процесса:
V 2 / V 1 = T2 / T1,
Работа этого процесса:
l = P·(V 2 - V 1).
Уравнение 1-го закона т/д имеет вид:
q = Du + l = ср·(t2 - t1);
Выражение для определения количества теплоты для 1 кг газа примет вид:
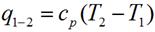 ;
;
для произвольной массы газа:
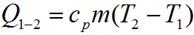 .
.
Таким образом, в изобарном процессе теплота расходуется на совершение работы и на изменение внутренней энергии рабочего тела.
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 2.3), которые называются изобарами.
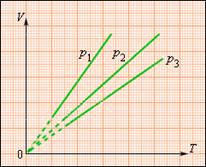 |
| Рисунок 2.2 -Семейство изобар на плоскости (V, T). p 3 > p 2 > p 1 |
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
3) Изотермический процесс (рис. 3) - квазистатический процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
|
Т = сonst, Т2 = Т1
|
|
|
Уравнение состояния:
P1 / P2 = V 2 / V 1,
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид:
q = l = R·T·ln(V 2/ V 1),
или q = l = R·T·ln(P1/P2),
где R = Rh/ i – газовая постоянная [Дж/(кг·К)].
Теплота, участвующая в изотермическом процессе, определится соотношением:
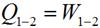
Это означает что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
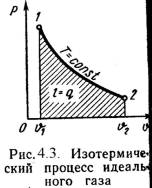
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.2). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
 Рисунок 3.2 -Семейство изотерм на плоскости (p, V). T 3 > T 2 > T 1 Рисунок 3.2 -Семейство изотерм на плоскости (p, V). T 3 > T 2 > T 1 |
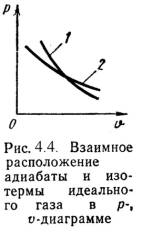
4) Адиабатный процесс (рис.4).
В данном процессе не подводится и не отводится тепло, т.е. процесс происходит без теплообмена с окружающей средой q =0.
Уравнение состояния:
P· Vk= const,
где k = cp / cv – показатель адиабаты.
Cвязь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
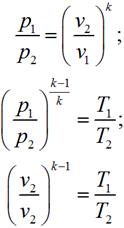
 2014-02-12
2014-02-12 47120
47120