Так как приведённая теплота системы при обратимом процессе не зависит от формы пути 1-2, а только от состояний системы в точках 1 и 2, то можно записать:
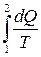 = S (2)− S (1)=Δ S 12, (12)
= S (2)− S (1)=Δ S 12, (12)
где S – это некоторая функция состояния системы в данной точке. Она называется энтропией системы в этой точке и является одним из важнейших понятий в термодинамике.
А так как S − функция состояния, то при элементарном обратимом процессе она является полным дифференциалом: 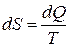 . Отсюда следует, что при адиабатном обратимом процессе, когда dQ =0, энтропия S =const, т.е.
. Отсюда следует, что при адиабатном обратимом процессе, когда dQ =0, энтропия S =const, т.е.
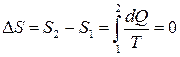 .
.
Однако формула (12) определяет не саму энтропию системы, а лишь разность энтропий в двух состояниях. Саму же энтропию S какого-либо состояния можно вычислить лишь после того, как будет определена энтропия какого-либо одного состояния.
Вальтер Нернст сформулировал постулат, называемый иногда третьим законом термодинамики: энтропия любого тела при абсолютном нуле равна нулю: S|Т =0=0. Это не совсем очевидно, так как интеграл (12) при Т →0 может и не сходиться. Однако обычно энтропию системы вычисляют не от Т =0, а от некоторого стандартного состояния М 0, в котором полагают S (М 0)=0. Тогда энтропия системы в произвольной точке М определяется так:
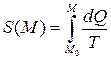 , (13)
, (13)
и она уже является только функцией состояния системы в точке М. Процесс М 0→ М может идти по любому пути, но он непременно должен быть обратим.
Пример. Вычислить изменение энтропии идеального газа в обратимом процессе.
Решение. Запишем первый закон термодинамики для идеального газа: 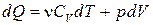
Подставляя сюда из уравнения состояния 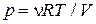 , получаем:
, получаем:
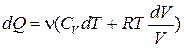 .
.
И тогда, по определению,
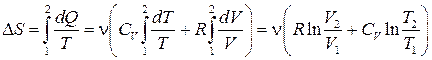 .
.
 2014-02-12
2014-02-12 700
700








