ПОЛУЧЕНИЕ СПИРТА-СЫРЦА
Летучесть отдельных компонентов смеси характеризуют коэффициентом испарения (К= Y/X) —отношением концентрации данного вещества в паровой фазе Y к концентрации его в жидкой фазе X при равновесном состоянии фаз.
Летучая часть бражки состоит в основном, из воды и этилового спирта, поэтому в процессе выделения спирта бражку рассматривают как бинарную смесь этилового спирта и воды. Зависимость между составом паровой и жидкой фазы летучих веществ определяется законами Д. П. Коновалова и М. С. Вревского.
В верхней части рис. 1 линия 1 изображает зависимость равновесного состава пара У от состава жидкости X при атмосферном давлении и температуре кипения для смеси этиловый спирт — вода. Она представляет собой геометрическое место точек значений коэффициентов испарения этилового спирта Kэ.c = Y/X из водно-спиртовой смеси. При малых концентрациях спирта в смеси значения Kэ.c максимальны (около 13), при больших — минимальны (около 1).
Линия равновесного состава в точке А пересекает диагональ, следовательно, в этой точке состав паровой и жидкой фазы одинаковый. Эта точка получила название азеотропной точки, или точки нераздельного кипения. Для нее Y=X, или Kэ.c = 1. При нормальном давлении нераздельнокипящая смесь системы этиловый спирт - вода содержит 97,2 об.% (95,57 мас.%) этилового спирта при температуре кипения 78,15°С; при том же давлении температура кипения этилового спирта равна 78,3°С, а воды 100°С.
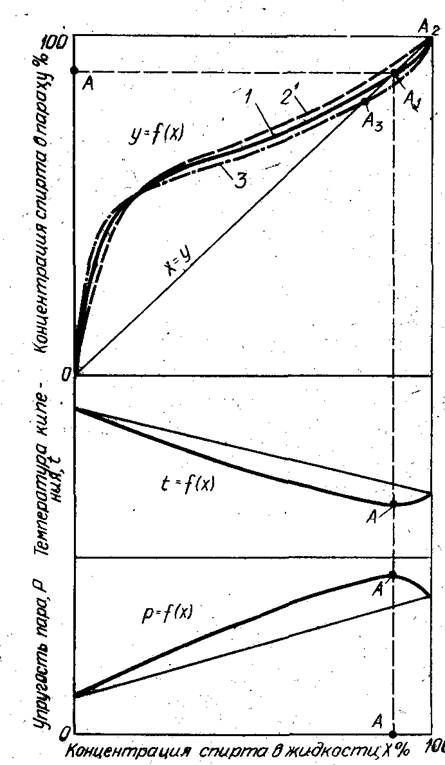
Рис. 1 Зависимость равновесного содержания пара. Температуры кипения и упругости пара от концентрации водно-спиртового раствора при давлении:
1 – атмосферное; 2 – ниже атмосферного; 3 – выше атмосферного.
В соответствии с законом Вревского при повышении давления растворы с низкой концентрацией спирта, примерно до 30— 40 мас.%, образуют пары с большим содержанием спирта, а растворы с высокой концентрацией спирта — пары с меньшим содержанием спирта, что наглядно показано в верхней части рис. 1 пунктирной линией. Из рисунка также видно, что с изменением давления сдвигается и положение азеотропной точки. Так, при давлении 93 кПа (температура кипения 27°С) нераздельнокипящая точка смещается вправо вплоть до Х= 100, т. е. при этом давлении пар всегда будет иметь большую концентрацию спирта, чем исходная жидкость (вплоть до 100%).
Анализируя положение кривой фазового равновесия, легко установить, что при атмосферном давлении пары над жидкостью будут обогащаться этиловым спиртом только до азеотропной тонки. Следовательно, путем ректификации (многократного испарения и конденсации) при атмосферном давлении можно достигнуть максимальной крепости спирта 97,2 об. %. Чтобы получить спирт большей крепости, необходимо уменьшить давление; тогда азеотропная точка сдвинется вправо, т. е. в область требующейся крепости. Этим приемом иногда пользуются на практике при получении абсолютного спирта.
Фазовое равновесие в бинарной смеси, этиловый спирт — вода при атмосферном давлении изучено В. Н. Стабниковым и О. Г. Мудравской. По их данным строят график фазового равновесия, который широко применяют для расчета процесса ректификации и анализа работы ректификационных колонн. В ряде случаев возникает необходимость иметь аналитическую зависимость указанного равновесия, которая по тем же данным установлена П. С. Цыганковым (табл.1).
Таблица 1.
| Интервалы концентраций, мол. % | Уравнения для Y, мол. % | |
| 0—23 | Х/(0,014595 + 0,0773) | |
| 23—55 | 0,395 Х + 45,52 | |
| 55-66,5 | 0,5087Х + 39,27 | |
| 66,5—82 | 0,6548X +29,56 | |
| 82—89,4. | 0,8113Х + 15,08 |
Наличие сухих веществ в водно-спиртовых растворах, как показано работами С. Е. Харина и В. М. Перелыгина, немного увеличивает концентрацию спирта в парах, однако в практических расчетах обычно пользуются кривой фазового равновесия для чистых водно-спиртовых растворов.
 2014-02-13
2014-02-13 6286
6286








