Пример 1. В баллоне объемом 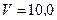 л находится гелий под давлением
л находится гелий под давлением 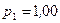 МПа и при температуре
МПа и при температуре 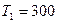 К. После того как из баллона было взято
К. После того как из баллона было взято 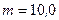 г гелия, температура понизилась до
г гелия, температура понизилась до 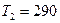 К. Определить давление
К. Определить давление 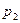 гелия, оставшегося в баллоне.
гелия, оставшегося в баллоне.
Решение. Для решения воспользуемся уравнением Мендеелева-Клапейрона, применив его к конечному состоянию газа:
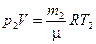 , (1)
, (1)
где 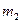 - масса гелия в баллоне в конечном состоянии; m - молярная масса гелия; R - молярная газовая постоянная.
- масса гелия в баллоне в конечном состоянии; m - молярная масса гелия; R - молярная газовая постоянная.
Из уравнения (1) выразим искомое давление 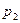 :
:
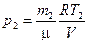 .
.
Массу 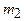 гелия выразим через массу
гелия выразим через массу 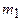 , соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
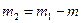 . (3)
. (3)
Массу гелия 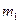 найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
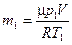 . (4)
. (4)
Подставляя в выражение (3) массу 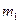 из формулы (4), а затем полученное выражение
из формулы (4), а затем полученное выражение 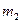 в формулу (2), найдем
в формулу (2), найдем
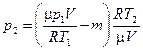 ,
,
или после преобразования и сокращения
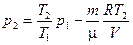 . (5)
. (5)
Убедившись в том, что размерность правой и левой частей формулы (5) одинакова, выразим величины, входящие в эту формулу, в единицах СИ и произведем вычисления: 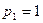 МПа = 106Па; m= 10г=10-2кг;
МПа = 106Па; m= 10г=10-2кг; 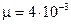 кг/моль;
кг/моль; 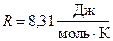 ;
; 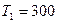 К;
К;
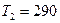 К;
К; 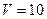 л=10-2 м3:
л=10-2 м3:
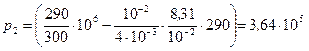 Па.
Па.
Ответ: 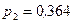 МПа.
МПа.
Пример 2. Баллон содержит 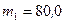 г кислорода и
г кислорода и 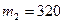 г аргона. Давление смеси
г аргона. Давление смеси 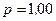 МПа, температура
МПа, температура 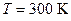 . Принимая данные газы за идеальные, определить объем V баллона.
. Принимая данные газы за идеальные, определить объем V баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Менделеева-Клапейрона, парциальные давления кислорода 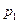 и аргона
и аргона 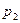 выражаются формулами
выражаются формулами 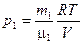 ;
; 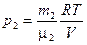 .
.
Следовательно, по закону Дальтона давление смеси газов
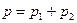 или
или 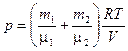 ,
,
откуда объем баллона
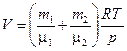 . (1)
. (1)
Выразим в единицах СИ числовые значения величин, входящих в эту формулу:
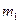 = 80г = 0,08кг;
= 80г = 0,08кг; 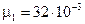 кг/моль;
кг/моль; 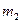 = 320г = 0,32кг;
= 320г = 0,32кг; 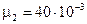 кг/моль;
кг/моль; 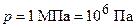 ;
; 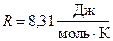 .
.
Подставим числовые значения в формулу (1) и произведем вычисления
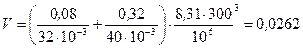 м3.
м3.
Ответ: 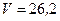 л.
л.
Пример 3. Найти среднюю кинетическую энергию 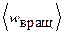 вращательного движения одной молекулы кислорода при температуре
вращательного движения одной молекулы кислорода при температуре 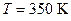 , а также кинетическую энергию
, а также кинетическую энергию 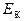 вращательного движения всех молекул кислорода массой
вращательного движения всех молекул кислорода массой 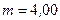 г.
г.
Решение. Известно, что на каждую степень свободы молекулы газа приходится одинаковая средняя энергия 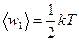 , где k - постоянная Больцмана; T - абсолютная температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода выразится формулой
, где k - постоянная Больцмана; T - абсолютная температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода выразится формулой
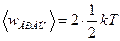 . (1)
. (1)
Подставив в формулу (1) значения 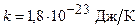 и
и 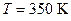 , получим
, получим
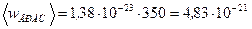 Дж.
Дж.
Кинетическая энергия вращательного движения всех молекул газа определяется равенством
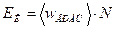 . (2)
. (2)
Число всех молекул газа можно вычислить по формуле
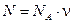 , (3)
, (3)
где 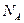 - число Авогадро; n - количество вещества.
- число Авогадро; n - количество вещества.
Если учесть, что количество вещества 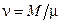 , где М - масса газа, m - молярная масса газа, то формула (3) примет вид
, где М - масса газа, m - молярная масса газа, то формула (3) примет вид
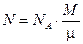 .
.
Подставив это выражение в формулу (2), получим
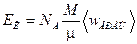 . (4)
. (4)
Выразим величины, входящие в эту формулу, в единицах СИ: 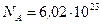 моль-1;
моль-1; 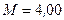 г=4,00·10-3 кг;
г=4,00·10-3 кг; 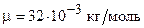 ;
; 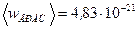 Дж.
Дж.
Подставив эти значения в формулу (4), найдем
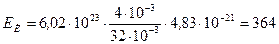 Дж.
Дж.
Ответ: 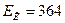 Дж.
Дж.
Пример 4. Вычислить удельные теплоемкости при постоянном объеме 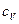 и при постоянном давлении
и при постоянном давлении 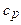 неона и водорода, принимая эти газы за идеальные.
неона и водорода, принимая эти газы за идеальные.
Решение. Удельные теплоемкости идеальных газов выражаются формулами
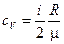 . (1)
. (1)
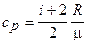 , (2)
, (2)
где i - число степеней свободы молекулы газа; m - молярная масса.
Для неона (одноатомный газ) 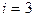 и
и 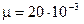 кг/моль (справочные данные). Вычисляя по формулам (1) и (2), получим:
кг/моль (справочные данные). Вычисляя по формулам (1) и (2), получим:
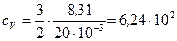 Дж/(кг·К);
Дж/(кг·К);
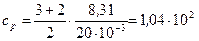 Дж/(кг·К).
Дж/(кг·К).
Для водорода (двухатомный газ) 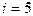 и
и 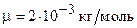 . Вычисляя по тем же формулам, получим:
. Вычисляя по тем же формулам, получим:
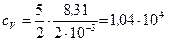 Дж/(кг·К);
Дж/(кг·К);
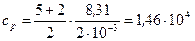 Дж/(кг·К).
Дж/(кг·К).
Ответ: неон 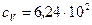 Дж/(кг·К),
Дж/(кг·К), 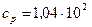 Дж/(кг·К);
Дж/(кг·К);
водород 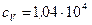 Дж/(кг·К),
Дж/(кг·К), 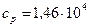 Дж/(кг·К).
Дж/(кг·К).
Пример 5. Вычислить удельные теплоемкости 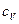 и
и 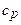 смеси неона и водорода, если массовая доля неона
смеси неона и водорода, если массовая доля неона 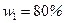 , массовая доля водорода
, массовая доля водорода 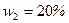 . Значения удельных теплоемкостей газов взять из предыдущего примера.
. Значения удельных теплоемкостей газов взять из предыдущего примера.
Решение. Удельную теплоемкость смеси при постоянном объеме 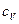 найдем следующим образом. Теплоту, необходимую для нагревания смеси на
найдем следующим образом. Теплоту, необходимую для нагревания смеси на 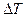 , выразим двумя способами:
, выразим двумя способами:
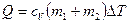 , (1)
, (1)
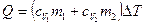 , (2)
, (2)
где 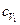 - удельная теплоемкость неона,
- удельная теплоемкость неона, 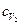 - удельная теплоемкость водорода.
- удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на 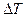 , получим:
, получим:
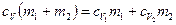 ,
,
откуда
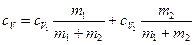 , (3)
, (3)
или
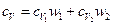 , (4)
, (4)
где 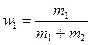 и
и 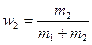 - массовые доли неона и водорода в смеси.
- массовые доли неона и водорода в смеси.
Подставив в формулу (4) числовые значения величин, найдем:
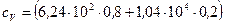 = 2,58·103 Дж/(кг·К).
= 2,58·103 Дж/(кг·К).
Рассуждая таким же образом, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
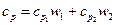 . (5)
. (5)
Подставим в формулу (5) числовые значения величин:
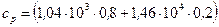 = 3,75·103 Дж/(кг·К).
= 3,75·103 Дж/(кг·К).
Ответ: 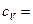 2,58·103 Дж/(кг·К),
2,58·103 Дж/(кг·К), 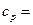 3,75·103 Дж/(кг·К).
3,75·103 Дж/(кг·К).
Пример 6. Кислород массой 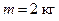 занимает объем
занимает объем 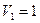 м3 и находится под давлением
м3 и находится под давлением 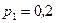 МПа. Газ был нагрет сначала при постоянном давлении до объема
МПа. Газ был нагрет сначала при постоянном давлении до объема 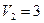 м3, а затем при постоянном объеме до давления
м3, а затем при постоянном объеме до давления 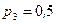 МПа. Найти изменение
МПа. Найти изменение 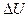 внутренней энергии газа, совершенную им работу A и теплоту Q, переданную газу. Построить график процесса.
внутренней энергии газа, совершенную им работу A и теплоту Q, переданную газу. Построить график процесса.
Решение. Изменение внутренней энергии газа выражается формулой
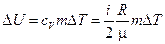 . (1)
. (1)
где i - число степеней свободы молекул газа (для двухатомных молекул кислорода 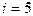 ); m - молярная масса.
); m - молярная масса.
Начальную и конечную температуру газа найдем из уравнения Менделеева-Клапейрона 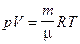 :
:
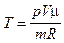 . (2)
. (2)
Выпишем заданные величины в единицах СИ: 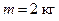 ;
; 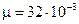 кг/моль;
кг/моль; 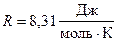 ;
; 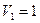 м3;
м3; 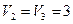 м3;
м3; 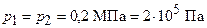 ;
; 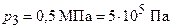 . Подставляя эти значения в выражение (2) и выполняя арифметические действия, получим:
. Подставляя эти значения в выражение (2) и выполняя арифметические действия, получим:
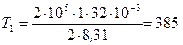 К
К
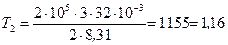 кК
кК
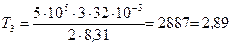 кК.
кК.
Подставляя в выражение (1) числовые значения величин, входящих в него, и выполняя арифметические действия, находим
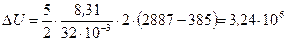 Дж.
Дж.
Работа расширения газа при постоянном давлении выражается формулой 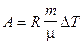 .
.
Подставив числовые значения величин, получим:
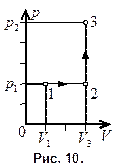
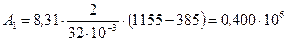 Дж
Дж
Работа газа, нагреваемого при постоянном объеме, равна нулю, т.е. 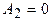 . Следовательно, полная работа, совершенная газом, равна
. Следовательно, полная работа, совершенная газом, равна
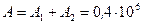 Дж.
Дж.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии 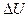 и работы A:
и работы A: 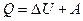 , следовательно,
, следовательно,
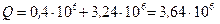 Дж.
Дж.
Ответ: 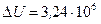 Дж,
Дж, 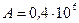 Дж,
Дж, 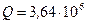 Дж.
Дж.
График процесса приведен на рис. 10
Пример 7. В цилиндре под поршнем находится водород массой 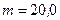 г при температуре
г при температуре 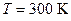 . Водород сначала расширился адиабатически, увеличив свой объем в
. Водород сначала расширился адиабатически, увеличив свой объем в 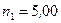 раз, а затем был сжат изотермически, причем объем газа уменьшился в
раз, а затем был сжат изотермически, причем объем газа уменьшился в 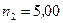 раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением
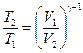 , или
, или 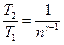 ,
,
где g - отношение теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме (для водорода, как двухатомного газа 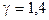 );
); 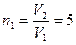 .
.
Отсюда получаем следующее выражение для конечной температуры 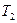 :
:
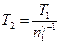 .
.
Подставляя числовые значения заданных величин, находим
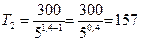 К.
К.
Работа 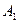 газа при адиабатическом расширении может быть определена по формуле
газа при адиабатическом расширении может быть определена по формуле
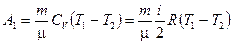 ,
,
где 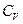 - молярная теплоемкость газа при постоянном объеме.
- молярная теплоемкость газа при постоянном объеме.
Подставив числовые значения величин: 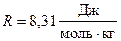 ;
; 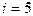 (для водорода как двухатомного газа),
(для водорода как двухатомного газа), 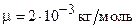 ,
, 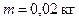 ,
, 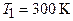 ,
, 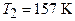 в правую часть последней формулы и выполняя арифметические действия, получим
в правую часть последней формулы и выполняя арифметические действия, получим
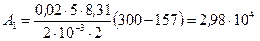 Дж.
Дж.
 Работа
Работа 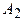 газа при изотермическом процессе может быть выражена в виде:
газа при изотермическом процессе может быть выражена в виде:
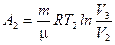 или
или 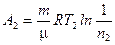 ,
,
где 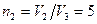 .
.
Подставляя известные числовые значения величин, входящих в правую часть этого равенства, и выполняя арифметические действия, находим:
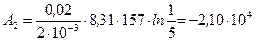 Дж
Дж
Знак «минус» показывает, что при сжатии работа газа совершается над газом внешними силами.
Ответ: 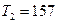 К,
К, 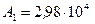 Дж,
Дж, 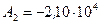 Дж.
Дж.
График процесса приведен на рис. 11.
Пример 8. Тепловая машина работает по обратимому циклу Карно. Температура нагревателя 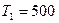 К. Определить термический к.п.д. h цикла и температуру
К. Определить термический к.п.д. h цикла и температуру 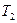 охладителя тепловой машины, если за счет каждого килоджоуля теплоты, полученной от нагревателя, машина совершает работу
охладителя тепловой машины, если за счет каждого килоджоуля теплоты, полученной от нагревателя, машина совершает работу 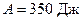 .
.
Решение. Термический к.п.д. тепловой машины, называемый также коэффициентом использования теплоты, показывает, какая доля теплоты, полученной от нагревателя, превращается в механическую работу. Термический к.п.д. выражается формулой
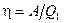 ,
,
где 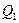 - теплота, полученная от нагревателя; A - работа, совершенная рабочим телом тепловой машины.
- теплота, полученная от нагревателя; A - работа, совершенная рабочим телом тепловой машины.
Подставив числовые значения в эту формулу, получим
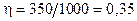 .
.
Зная к.п.д. цикла, можно по формуле 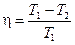 определить температуру охладителя
определить температуру охладителя 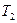 :
:
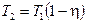 .
.
Подставив в эту формулу полученное значение к.п.д. и температуры 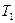 нагревателя, получим
нагревателя, получим
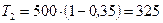 К.
К.
Ответ: 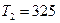 К.
К.
Пример 9. Цилиндрический термос с внешним радиусом 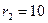 см, внутренним
см, внутренним 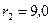 см и высотой
см и высотой 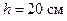 наполнен льдом. Температура льда
наполнен льдом. Температура льда 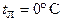 ; наружная температура воздуха
; наружная температура воздуха 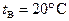 . 1) При каком предельном давлении
. 1) При каком предельном давлении 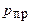 воздуха между стенками термоса коэффициент теплопроводности еще будет зависеть от давления? Диаметр молекул воздуха принять равным
воздуха между стенками термоса коэффициент теплопроводности еще будет зависеть от давления? Диаметр молекул воздуха принять равным 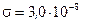 см температуру воздуха, находящегося между стенками термоса, считать равной среднему арифметическому температур льда и окружающего пространства. 2) Найти коэффициент теплопроводности воздуха K, заключенного между стенками термоса, при давлении
см температуру воздуха, находящегося между стенками термоса, считать равной среднему арифметическому температур льда и окружающего пространства. 2) Найти коэффициент теплопроводности воздуха K, заключенного между стенками термоса, при давлении 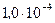 мм рт. ст.
мм рт. ст.
Решение. Коэффициент теплопроводности воздуха начнет зависеть от давления при 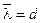 , где
, где 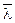 - средняя длина свободного пробега молекул газа, d - расстояние между стенками термоса. Имеем
- средняя длина свободного пробега молекул газа, d - расстояние между стенками термоса. Имеем 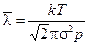 , откуда при
, откуда при 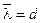 получим
получим 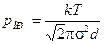 . Подставляя числовые данные задачи, получим
. Подставляя числовые данные задачи, получим 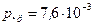 мм рт.ст.
мм рт.ст.
Если 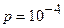 мм рт.ст., то средняя длина свободного пробега l больше расстояния между стенками термоса. Тогда
мм рт.ст., то средняя длина свободного пробега l больше расстояния между стенками термоса. Тогда
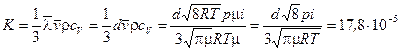 Вт/(м·К).
Вт/(м·К).
Ответ: 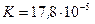 Вт/(м·К).
Вт/(м·К).
 2015-01-21
2015-01-21 2480
2480
