14. Внутренняя энергия идеального газа:
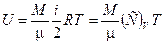 .
.
15. Первое начало термодинамики:
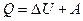 ,
,
где Q - теплота, сообщенная системе (газу); 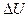 - изменение внутренней энергии системы; A - работа, совершенная системой против внешних сил.
- изменение внутренней энергии системы; A - работа, совершенная системой против внешних сил.
16. Работа расширения газа:
- в общем случае 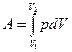 ;
;
- при изобарическом процессе 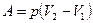 ;
;
- при изотермическом процессе 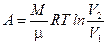 ;
;
- при адиабатическом процессе 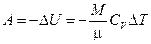
или 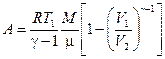 ,
,
где 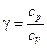 - показатель адиабаты.
- показатель адиабаты.
17. Термический к.п.д. цикла
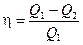 ,
,
где 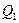 - теплота, полученная рабочим телом от нагревателя;
- теплота, полученная рабочим телом от нагревателя; 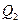 - теплота, переданная рабочим телом охладителю.
- теплота, переданная рабочим телом охладителю.
18. Термический к.п.д. цикла Карно:
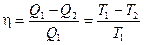 .
.
где 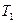 и
и 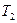 - термодинамические температуры нагревателя и охладителя.
- термодинамические температуры нагревателя и охладителя.
19. Второй закон термодинамики определяет направление происходящих в природе процессов, связанных с превращением энергии. Существует несколько формулировок данного закона:
Р. Клаузиус: - Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
У. Томсон (Кельвин): - В природе невозможен процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара.
М. Планк: - В природе невозможен процесс, единственным результатом которого был бы переход теплоты полностью в работу.
Данный закон отрицает возможность использования запасов внутренней энергии какого-либо источника без перевода его на более низкий температурный уровень, т.е. без холодильника.
Второе начало термодинамики утверждает невозможность построения вечного двигателя второго рода – двигателя работающего за счет охлаждения какого-либо одного тела.
Приведенное количество теплоты 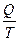 - величина равная отношению теплоты
- величина равная отношению теплоты 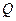 , полученной телом при изотермическом процессе, к температуре
, полученной телом при изотермическом процессе, к температуре 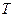 , при которой происходит теплопередача.
, при которой происходит теплопередача.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно 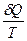 . В любом обратимом круговом процессе приведенное количество теплоты, сообщаемое телу, равно нулю
. В любом обратимом круговом процессе приведенное количество теплоты, сообщаемое телу, равно нулю
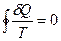 . (19.1)
. (19.1)
Поскольку интеграл по замкнутому контуру равен нулю, подынтегральное выражение является полным дифференциалом некоторой функции состояния 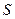
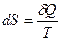 . (19.2)
. (19.2)
Эта функция называется энтропией. Единица измерения энтропии – 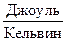 (Дж/К).
(Дж/К).
Энтропия S - функция, характеризующая направление протекания самопроизвольного процесса в замкнутой термодинамической системе.
Из формулы (19.1) следует, что для обратимых процессов изменение энтропии
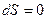 ,
, 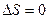 . (19.3)
. (19.3)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает
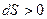 ,
, 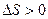 . (19.4)
. (19.4)
Соотношения (19.3) (19.4) можно представить в виде неравенства Клаузиуса
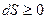 ,
, 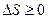 . (19.5)
. (19.5)
Неравенство Клаузиуса является математическим выражение второго начала термодинамики: - Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
20. Приращение энтропии 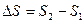 определяется формулой (интегралом приведенных теплот):
определяется формулой (интегралом приведенных теплот):
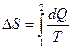 ,
,
где 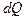 - тепло, подведенное к системе при изотермическом процессе.
- тепло, подведенное к системе при изотермическом процессе.
 2015-01-21
2015-01-21 733
733








