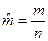 ,
, 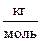 . (7)
. (7)
Определяется объем смеси газов
V = 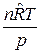 , м3, (8)
, м3, (8)
где 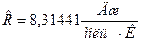 молярная газовая постоянная, Т – температура. В сечении 2-2 температура задана и равна Т 2 = 298,15К, р - давление в камере сгорания p =
молярная газовая постоянная, Т – температура. В сечении 2-2 температура задана и равна Т 2 = 298,15К, р - давление в камере сгорания p =  =101325 Па, где
=101325 Па, где 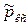 - заданная величина.
- заданная величина.
Определяется плотность смеси газов
 (9)
(9)
Определяется удельная газовая постоянная смеси газов
R =  (10)
(10)
Определяется энтальпия смеси индивидуальных веществ
H = 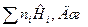 (11)
(11)
где 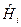 -молярная энтальпия i-го вещества.
-молярная энтальпия i-го вещества.
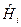 =
= 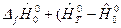 ),
), 
где  - энтальпия образования i- го индивидуального вещества при Т0=0К,
- энтальпия образования i- го индивидуального вещества при Т0=0К,  - избыточная энтальпия при нагреве вещества от Т0 до температуры Т.
- избыточная энтальпия при нагреве вещества от Т0 до температуры Т.  и
и  -определяются из таблиц индивидуальных веществ.
-определяются из таблиц индивидуальных веществ.
Определяется энтропия смеси газов
S = 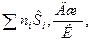 (12)
(12)
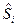 =
= 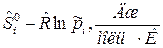 ,
,
где 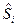 - молярная энтропия, которая зависит от температуры и давления;
- молярная энтропия, которая зависит от температуры и давления; 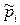 =
=  -парциальное давление i -ой компоненты смеси газов, отнесенное к давлению в одну физическую атмосферу p 0=101325Па;
-парциальное давление i -ой компоненты смеси газов, отнесенное к давлению в одну физическую атмосферу p 0=101325Па; 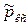 - относительное давление смеси газов в камере сгорания ЖРД (величина заданная);
- относительное давление смеси газов в камере сгорания ЖРД (величина заданная);  - молярная энтропия i-го вещества при давлении р 0=101325Па (берется из таблиц индивидуальных веществ).
- молярная энтропия i-го вещества при давлении р 0=101325Па (берется из таблиц индивидуальных веществ).
Расчет параметров, характеризующих дифференциальные свойства системы в сечении 2-2 камеры сгорания ЖРД.
Определяется изобарная теплоемкость смеси газа
 =
=  ,
, 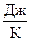 , (13)
, (13)
где 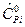 ,
, 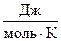 - молярная изобарная теплоемкость i -го компонента смеси берется из таблиц справочника.
- молярная изобарная теплоемкость i -го компонента смеси берется из таблиц справочника.
По уравнению Майера определяется изохорная теплоемкость смеси газов
Cv=Cp- n  ,
, 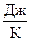 . (14)
. (14)
Определяется показатель адиабаты смеси газов
к =  (15)
(15)
Определяется скорость звука
 (16)
(16)
Расчет параметров химически реагирующей смеси газов в сечении 3-3 камеры сгорания ЖРД.
Процесс сгорания топлива в камере сгорания ЖРД (2-3) является изобарно-адиабатно-изоэнтальпийным (dp =  ), так как теплота извне к системе не подводится и согласно уравнению 1-го закона термодинамики для простой закрытой системы dН =
), так как теплота извне к системе не подводится и согласно уравнению 1-го закона термодинамики для простой закрытой системы dН =  , т.е. энтальпия в сечении 3-3 камеры сгорания должна быть равна энтальпии в сечении 2-2: Н 3= Н 2.
, т.е. энтальпия в сечении 3-3 камеры сгорания должна быть равна энтальпии в сечении 2-2: Н 3= Н 2.
Увеличение температуры рабочего тепла в камере сгорания двигателя происходит за счет выделения тепловой энергии при протекании химической реакции сгорания топлива. При этом задача определения температуры на выходе из камеры сгорания – Т3 и химического состава продуктов сгорания сводится к расчету равновесного состояния системы в сечении 3-3 при двух фиксированных параметрах: давлении (р 3= р 2) и энтальпии (Н3=Н2).
В соответствии со 2-м законом термодинамики энтропия системы будет возрастать из-за необратимого протекания процесса сгорания топлива и при достижении состояния равновесия примет значение, соответствующее максимуму энтропии. Таким образом, процесс сгорания в камере сгорания ЖРД соответствует переходу системы из химически неравновесного в равновесное состояние, которое полностью определяется заданием двух независимых термодинамических параметров (в данном случае: p=const и H=const).
Состав реагирующей смеси газов в начальный момент химической реакции определяется числами молей веществ, впрыскиваемых в камеру сгорания через форсунки, -  ,моль.
,моль.
Например, для реакции:
2CH+  O2=2CO2+H2O,
O2=2CO2+H2O,
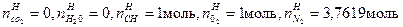 ,
,
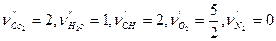 ,
,
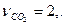
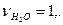


 .
.
Текущие значения количеств веществ для термодинамической системы с учетом одной химической реакции определяются соотношением 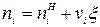 , где
, где  - количество i-ой компоненты смеси в начальный момент реакции; x - величина пробега химической реакции, которая полностью характеризует в этом случае степень изменения состава системы при химической реакции. Она показывает, насколько сдвинулась реакция по отношению к начальному состоянию термодинамической системы. Неизвестная величина x при переходе системы в равновесное состояние определяется из условия равенства нулю сродства химической реакции А, которое при сопряжении термодинамической системы с окружающей средой р, Т=const имеет вид:
- количество i-ой компоненты смеси в начальный момент реакции; x - величина пробега химической реакции, которая полностью характеризует в этом случае степень изменения состава системы при химической реакции. Она показывает, насколько сдвинулась реакция по отношению к начальному состоянию термодинамической системы. Неизвестная величина x при переходе системы в равновесное состояние определяется из условия равенства нулю сродства химической реакции А, которое при сопряжении термодинамической системы с окружающей средой р, Т=const имеет вид:
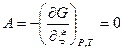 , или dGp,T =0.
, или dGp,T =0.
При А=О достигается состояние равновесия системы. При этом свободная энергия Гиббса G=G (x) принимает минимальное значение, а пробег химической реакции x=x*рав. Для системы, состоящей из смеси идеальных газов
 , Дж,
, Дж,
где  . После преобразований с учетом, что
. После преобразований с учетом, что  , имеем:
, имеем: 
Тогда А = - 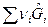 =
= 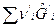 -
- 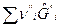 =0.
=0.
При отклонении от состояния равновесия dG >0 если dx >0, то A<0 и если dx <0, то A>0.
Реакция слева направо может идти до тех пор, пока в системе присутствуют все реагенты, имеющиеся в левой части уравнения химической реакции, т.е.
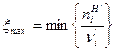 . (17)
. (17)
Фигурные скобки означают, что необходимо рассмотреть отношение (n 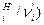 для всех реагентов, участвующих в химической реакции, и выбрать наименьшее значение. Для рассматриваемой химической реакции
для всех реагентов, участвующих в химической реакции, и выбрать наименьшее значение. Для рассматриваемой химической реакции  моль. Для ХР, протекающей справа налево имеем:
моль. Для ХР, протекающей справа налево имеем:
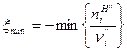 (18)
(18)
Для рассматриваемой ХР  моль.
моль.
 2015-01-21
2015-01-21 565
565








