Для цикла Карно из формул (10.17) и (10.21) легко получить соотношение
Q1 /T1 - Q2 /T2 = 0. (10.22)
Величину Q/T называют приведенной теплотой, где Q - количество тепла, переданного телу при температуре T. Из соотношения (10.22) следует, что для цикла Карно, являющегося обратимым, алгебраическая сумма приведенных теплот равна нулю. Понятие приведенных теплот можно применить для анализа произвольных тепловых процессов. Так как температура тел T изменяется во время процессов, то рассматривают малое количество передаваемой теплоты dQ и вводят новую величину S, называемую энтропией, элементарное изменение которой равно
dS = dQ / T. (10.23)
При переходе системы из состояния 1 в состояние 2 полное изменение энтропии
DS = S2 - S1 = 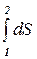 =
= 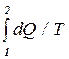 . (10.24)
. (10.24)
Рассчитаем изменение энтропии для идеального газа массой m. По первому началу термодинамики dQ = dU + dA. Подставляя dQ в (10.23) и учитывая, что в согласии с (10.9) dU = (m /m)C v dT и dA = pdV, получим
dS = (m /m)C v dT/T + pdV/T. (10.25)
Выразив p из уравнения pV = (m /m)RT и подставляя его в (10.25), а затем, подставив это равенство в (10.24), получим
|
|
|
S2 - S1 = (m /m)C v 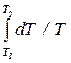 + (m /m)R
+ (m /m)R 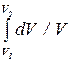
или после интегрирования
S2 - S1 = (m /m)C v ln(T2 /T1) + (m /m)R ln(V2 /V1). (10.26)
Из выражения (10.26) следует, что энтропия зависит лишь от параметров V и T, т.е. является функцией состояния системы. Это означает, что если система совершит некоторые процессы и вернется в итоге к тем же параметрам V и T, то и энтропия ее примет прежнее значение.
 2015-01-21
2015-01-21 704
704








