Экспериментальный факт:
По данным рентгеноструктурного анализа, в карбонат-ионе все связи С—О имеют одинаковую длину, все атомы кислорода — одинаковую электронную плотность.
Чтобы передать строение этой частицы, необходимо воспользоваться набором из трёх предельных структур:
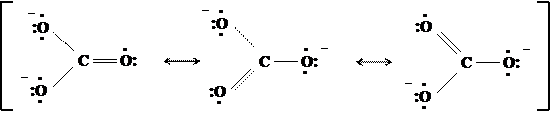
Как видно, данные резонансные структуры не отличаются расположением атомов, они различаются только распределением электронов между ними. Хотя, согласно концепции резонанса, граничные структуры в действительности не существуют, а являются лишь формулами, однако наложением их друг на друга можно представить распределение электронов в реальной частице. Такой «резонансный гибрид» называется мезоформулой. Если канонические структуры равноценны между собой по энергии (как в карбонат-ионе), то они вносят равный вклад в реальное строение молекулы (имеют одинаковый «удельный вес»).
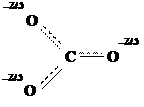
Мезоформула показывает, что в этом анионе нет чисто простых и чисто двойных связей. Все связи имеют нецелочисленную кратность. Аналогично, ни на одном из атомов кислорода нет целого отрицательного заряда: все заряды дробные, их величины равны между собой. Такое распределение электронов называется делокализацией. Оно соответствует экспериментальным данным.
Рассмотрим гидролиз карбоната натрия Na2CO3. Для составления уравнений гидролиза Na2CO3 по ступеням исходим из следующего положения. Соль образована сильным основанием и слабой кислотой. Ион слабой кислоты будет связывать ионы водорода воды. Поскольку ион несет две единицы заряда, то следует рассматривать две ступени гидролиза. Для каждой ступени надо уметь записывать три вида уравнений: а) в сокращенной ионной форме; б) в ионной форме;
в) в молекулярной форме.
Первая ступень:
а)  + Н2О
+ Н2О 
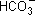 + ОН–;
+ ОН–;
б) к ионам этого уравнения приписываем ионы противоположного знака:
2Nа+ 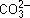 + Н2О
+ Н2О  Nа+
Nа+ 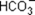 + ОН– + Nа+;
+ ОН– + Nа+;
в) записываем ионы предыдущего уравнения в виде химических формул веществ и получаем уравнение гидролиза в молекулярной форме:
Nа2СО3 + Н2О 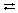 NаНСО3 + NаОН.
NаНСО3 + NаОН.
Вторая ступень:
а) 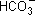 + Н2О
+ Н2О 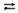 Н2СО3 + ОН–;
Н2СО3 + ОН–;
б) Nа+ 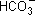 + Н2О
+ Н2О 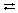 Н2СО3 + Nа+ ОН–;
Н2СО3 + Nа+ ОН–;
в) NаНСО3 + Н2О 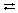 Н2СО3 + NаОН.
Н2СО3 + NаОН.
В обычных условиях гидролиз протекает главным образом по первой ступени: ионы связывают ионы водорода Н+ воды, образуя сначала, и лишь при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
Итак, в результате гидролиза соли, образованной слабой кислотой и сильным основанием, ионы водорода Н+ (от молекул воды Н2О) образуют с ионами устойчивые ионы. В растворе накапливаются свободные ионы ОН–, поэтому среда становится щелочной, [Н+] < [ОН–].
Общая характеристика p-элементов IIIA подгруппы. Алюминий. Распростра-нённость и формы нахождения в природе. Промышленное производство алюминия. Физические и химические свойства алюминия. Алюминотермия. Сплавы алюминия.
К III группе относятся бор, алюминий, галлий, индии, таллий (главная подгруппа), а также скандий, иттрий, лантан и лантаноиды, актиний и актиноиды (побочная подгруппа). На внешнем электронном уровне элементов главной подгруппы имеется по три электрона (s2р1). Они легко отдают эти электроны или образуют три неспаренных электрона за счет перехода одного электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по три электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.
Электронное строение валентного слоя актиноидов во многом напоминает электронное строение валентного слоя лантаноидов. Все лантаноиды и актиноиды -- типичные металлы. Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты. Элементы III группы находят самое разнообразное применение.
Бор был открыт Ж. Гей-Люссаком и Л. Тенаром в 1808 г. Содержание его в земной коре составляет 1,2•10-3 %. Соединения бора с металлами (б о р и д ы) обладают высокой твердостью и термостойкостью. Поэтому их используют для получения сверхтвердых и жаропрочных специальных сплавов. Большой термостойкостью обладают карбид и нитрид бора. Последний применяют в качестве высокотемпературной смазки. Кристаллогидрат тетрабората натрия Nа2В4O7•10Н2О (бура) имеет постоянный состав, его растворы применяют в аналитической химии для установления концентрации растворов кислот. Содержание галлия в земной коре составляет 1,9•10-3 %. Он был предсказан Д. И. Менделеевым (экаалюминий) и открыт французским химиком Р. Э. Лекок де Буабодраном в 1875 г. Свойства галлия почти полностью совпали со свойствами экаалюминия, предсказанными Д, И. Менделеевым на основе периодического закона.
Соединения галлия с элементами VI группы (серой, селеном, теллуром) являются полупроводниками. Жидким галлием наполняют высокотемпературные термометры.
Индий был открыт Т. Рихтером и Ф. Райхом в 1863 г. Содержание его в земной коре составляет 2,5•10-5 %. Добавка индия к сплавам меди увеличивает устойчивость последних к действию морской воды. Присадка этого металла к серебру увеличивает блеск серебра и препятствует его тускнению на воздухе. Индиевые покрытия предохраняют металлы от коррозии. Он входит в состав некоторых сплавов, применяющихся в стоматологии, а также некоторых легкоплавких сплавов (сплав индия, висмута, свинца, олова и кадмия плавится при 47 °С). Соединения индия с различными неметаллами обладают полупроводниковыми свойствами.
Таллий был открыт У. Круксом в 1861 г. Содержание его в земной коре составляет 10-4 %. Сплав таллия (10 %) с оловом (20 %) и свинцом (70 %) обладает очень высокой кислотоупорностью, он выдерживает действие смеси серной, соляной и азотной кислот. Таллий повышает чувствительность фотоэлементов к инфракрасному излучению, исходящему от нагретых предметов. Соединения таллия весьма ядовиты и вызывают выпадение волос. Галлий, индий и таллий относятся к рассеянным элементам. Содержание их в рудах, как правило, не превышает тысячных долей процент.
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых! Алюминий входит в огромное число минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др.
Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.
Важнейший минерал алюминия – боксит, смесь основного оксида AlO(OH) и гидроксида Al(OH)3. Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее и на Ямайке; промышленная добыча ведется и в других странах, включая такие как Германия. Богаты алюминием также алунит (квасцовый
камень)(Na,K)2SO4·Al2(SO4)3·4Al(OH)3, нефелин (Na,K)2O·Al2O3·2SiO2.
Всего же известно более 250 минералов, в состав которых входит алюминий; большинство из них – алюмосиликаты, из которых и образована в основном земная кора.
Нахождение в природе. Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли% или 8 масс.%. Главная масса его сосредоточена в алюмосиликатах. Чрезвычайно распространенным продуктом разрушения образованных ими горных пород является глина, основной состав которой отвечает формуле Al2O3.2SiO2.2H2O. Из других природных форм нахождения алюминия наибольшее значение имеют боксит Al2O3.xH2O и минералы корунд Al2O3 и криолит AlF3.3NaF.
Получение. В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Температура плавления Al2O3 около 2050оС, а криолита - 1100оС. Электролизу подвергают расплавленную смесь криолита и Al2O3, содержащую около 10 масс.% Al2O3, которая плавится при 960оС и обладает электрической проводимостью, плотностью и вязкостью, наиболее благоприятствующими проведению процесса. При добавлении AlF3, CaF2 и MgF2 проведение электролиза оказывается возможным при 950оС. Электролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичом. Его дно (под), собранное из блоков спрессованного угля, служит катодом. Аноды располагаются сверху: это - алюминиевые каркасы, заполненные угольными брикетами.
Al2O3 = Al3+ + AlO33-
На катоде выделяется жидкий алюминий: Al3+ + 3е- = Al
Алюминий собирается на дне печи, откуда периодически выпускается. На аноде выделяется кислород: 4AlO33- - 12е- = 2Al2O3 + 3O2
Кислород окисляет графит до оксидов углерода. По мере сгорания углерода анод наращивают. Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости. Физические свойства алюминия. Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддается ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и других видами сварки. Решетка Алюминия кубическая гранецентрированная с параметром а = 4,0413 A. Свойства Алюминий, как и всех металлов, в значит, степени зависят от его чистоты. Свойства Алюминия особой чистоты (99,996%): плотность (при 20 °С) 2698,9 кг/м3; tпл 660,24 °С; tкип около 2500 °С; коэффициент термического расширения (от 20° до 100 °С) 23,86·10-6; теплопроводность (при 190 °С) 343 вт/м·К [0,82 кал/(см·сек·°С)], удельная теплоемкость (при 100 °С) 931,98 дж/кг·К. [0,2226 кал/(г·°С)]; электропроводность по отношению к меди (при 20 °С) 65,5%. Алюминий обладает невысокой прочностью (предел прочности 50-60 Мн/м2), твердостью (170 Мн/м2 по Бринеллю) и высокой пластичностью (до 50%). При холодной прокатке предел прочности Алюминия возрастает до 115 Мн/м2, твердость - до 270 Мн/м2, относительное удлинение снижается до 5% (1 Мн/м2~ и 0,1 кгс/мм2). Алюминий хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, Алюминий на воздухе покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность оксидной пленки и защитное действие ее сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. Алюминий стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой, с органических кислотами, пищевыми продуктами.
Химические свойства. При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и взаимодействие его с серой. С хлором и бромом соединение происходит уже при обычной температуре, с иодом - при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом. Напротив, с водородом он не взаимодействует.
По отношению к воде алюминий вполне устойчив. Но если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция: 2Al + 6H2O = 2Al(OH)3 + 3H2
Сильно разбавленные, а также очень концентрированные HNO3 и H2SO4 на алюминий почти не действуют (на холоду), тогда как при средних концентрациях этих кислот он постепенно растворяется. Чистый алюминий довольно устойчив и по отношению к соляной кислоте, но обычный технический металл в ней растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты - соли, содержащие алюминий в составе аниона:
Al2O3 + 2NaOH + 3H2O = 2Na [Al(OH)4]
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород: 2Al + 6H2O = 2Al(OH)3 + 3H2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат: Al(OH)3 + NaOH = Na [Al(OH)4]
Суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al + 2NaOH + 6H2O = 2Na [Al(OH)4] + 3H2
Алюминий заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Na2CO3.
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.
Соединение алюминия с кислородом сопровождается громадным выделением тепла (1676 кДж/моль Al2O3), значительно большим, чем у многих других металлов. В виду этого при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Mn, V, W и др.) в свободном состоянии.
Алюмотермией иногда пользуются для сварки отдельных стальных частей, в часности стыков трамвайных рельсов. Применяемая смесь («термит») состоит обычно из тонких порошков алюминия и Fe3O4. Поджигается она при помощи запала из смеси Al и BaO2. Основная реакция идет по уравнению:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe + 3350 кДж
Причем развивается температура около 3000оС.
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Обычно загрязненный оксидом железа природный корунд вследствие своей чрезвычайной твердости применяется для изготовления шлифовальных кругов, брусков и т.д. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются Al2O3, получаемым сплавлением боксита (техническое название - алунд).
Прозрачные окрашеннные кристаллы корунда - красный рубин - примесь хрома - и синий сапфир - примесь титана и железа - драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют в качестве квантовых генераторов - лазеров, создающих направленный пучок монохроматического излучения.
Ввиду нерастворимости Al2O3 в воде отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH - постепенно замещаются в аквокомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH- = [Al(OH) (OH2)5]2+ + H2O
[Al(OH) (OH2)5]2+ + OH- = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH- = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида - алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na [Al(OH)4]
Общая характеристика p-элементов IIIA подгруппы. Соединения алюминия. Амфотерность оксида и гидроксида. Особенности строения галогенидов алюминия. Комплексные галогениды. Криолит. Гидролиз солей алюминия в водных растворах. Квасцы.
К III группе относятся бор, алюминий, галлий, индии, таллий (главная подгруппа), а также скандий, иттрий, лантан и лантаноиды, актиний и актиноиды (побочная подгруппа).
На внешнем электронном уровне элементов главной подгруппы имеется по три электрона (s2р1). Они легко отдают эти электроны или образуют три неспаренных электрона за счет перехода одного электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по три электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.
Электронное строение валентного слоя актиноидов во многом напоминает электронное строение валентного слоя лантаноидов. Все лантаноиды и актиноиды -- типичные металлы.
Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты.
Элементы III группы находят самое разнообразное применение.
Бор был открыт Ж. Гей-Люссаком и Л. Тенаром в 1808 г. Содержание его в земной коре составляет 1,2•10-3 %.
Соединения бора с металлами (б о р и д ы) обладают высокой твердостью и термостойкостью. Поэтому их используют для получения сверхтвердых и жаропрочных специальных сплавов. Большой термостойкостью обладают карбид и нитрид бора. Последний применяют в качестве высокотемпературной смазки. Кристаллогидрат тетрабората натрия Nа2В4O7•10Н2О (бура) имеет постоянный состав, его растворы применяют в аналитической химии для установления концентрации растворов кислот.
Содержание галлия в земной коре составляет 1,9•10-3 %. Он был предсказан Д. И. Менделеевым (экаалюминий) и открыт французским химиком Р. Э. Лекок де Буабодраном в 1875 г. Свойства галлия почти полностью совпали со свойствами экаалюминия, предсказанными Д, И. Менделеевым на основе периодического закона.
Соединения галлия с элементами VI группы (серой, селеном, теллуром) являются полупроводниками. Жидким галлием наполняют высокотемпературные термометры.
Индий был открыт Т. Рихтером и Ф. Райхом в 1863 г. Содержание его в земной коре составляет 2,5•10-5 %. Добавка индия к сплавам меди увеличивает устойчивость последних к действию морской воды. Присадка этого металла к серебру увеличивает блеск серебра и препятствует его тускнению на воздухе. Индиевые покрытия предохраняют металлы от коррозии. Он входит в состав некоторых сплавов, применяющихся в стоматологии, а также некоторых легкоплавких сплавов (сплав индия, висмута, свинца, олова и кадмия плавится при 47 °С). Соединения индия с различными неметаллами обладают полупроводниковыми свойствами.
Таллий был открыт У. Круксом в 1861 г. Содержание его в земной коре составляет 10-4 %. Сплав таллия (10 %) с оловом (20 %) и свинцом (70 %) обладает очень высокой кислотоупорностью, он выдерживает действие смеси серной, соляной и азотной кислот. Таллий повышает чувствительность фотоэлементов к инфракрасному излучению, исходящему от нагретых предметов. Соединения таллия весьма ядовиты и вызывают выпадение волос.
Галлий, индий и таллий относятся к рассеянным элементам. Содержание их в рудах, как правило, не превышает тысячных долей процент.
Соединения алюминия. Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050 оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH- постепенно замещаются в аквокомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH- = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH- = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH- = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов).
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый. Будучи заметно летучими уже при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза). Они могут быть получены прямым взаимодействием простых веществ.
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне. Из остальных производных алюминия следует упомянуть его ацетат (иначе — уксуснокислую соль) Al(CH3COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
 2015-01-30
2015-01-30 9391
9391
