При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметан.
Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
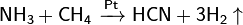
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов углерод образует карбиды, например:
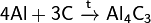
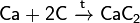
Важна в промышленности реакция углерода с водяным паром:
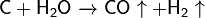
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Органические соединения. Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Алмаз — прозрачные бесцветные кристаллы. У алмаза атомная кристаллическая решетка. Каждый атом в кристаллической решетке алмаза соединен ковалентными связями с четырьмя соседними атомами, так что кристалл алмаза поэтому сравнивают с единой молекулой. Атомные кристаллические решетки обладают большой прочностью: алмаз — самое твердое из природных веществ. Мелкие алмазы используют для бурения горных пород, в стеклорезах. Алмазный порошок используется для шлифовки драгоценных камней. Огранённые алмазы называются бриллиантами.
Графит — темно-серое вещество со слабым металлическим блеском. Кристалл графита состоит из слоев, в которых атомы связаны ковалентными связями. Связь между слоями обладает свойствами металлической связи (т.е. электроны принадлежат всем атомам). Поэтому графит проводит электрический ток. Слои графита слабо связаны: расслаиваются и скользят относительно друг друга, поэтому графит применяется в простых карандашах и в графитовой смазке.
Сажу, древесный уголь, кокс рассматривают как аморфную (состоящую из мелких частиц) разновидность графита.
Сажа используется как наполнитель для черной резины, получения черной краски. Древесный уголь в виде порошка применяется в противогазах, таблетках и фильтрах для воды, т.к. поглощает, адсорбирует на своей поверхности различные примеси, вредные вещества. Кокс в металлургии применяется для выплавки чугуна. Угольные (графитовые) стержни применяются в качестве электродов.
Углеродом образованы также графен, лонсдейлит, карбин, фуллерит.
Графит сгорает в кислороде с образованием оксида углерода (IV), или углекислого газа:
C + O2 = CO2
Соединения углерода в разных степенях окисления. Оксид углерода (II). Строе-ние молекулы. Физические и химические свойства. Комплексные карбонилы. Фосген. Цианиды и комплексные цианиды.
Соединения с отрицательной степенью окисления. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода –4. По типу химической связи можно выделить ковалентные, ионно-ковалентные и металлические карбиды.
Ковалентные карбиды кремния SiC и бора B4C – полимерные вещества, характеризующиеся очень высокой твердостью, тугоплавкостью и химической инертностью.
Простейшим ковалентным карбидом является метан СН4 – химически весьма инертный газ; на него не действуют кислоты и щелочи, однако он легко загорается, и его смеси с воздухом чрезвычайно взрывоопасны. Метан – основной компонент природного (60–90%) рудничного и болотного газа. Богатые метаном газы используются как топливо и сырье для химического производства.
Углерод образует многообразные перкарбиды, например, некоторые простейшие углеводороды – этан С2Н6, этилен С2Н4, ацетилен С2Н2.
Ионно-ковалентные карбиды – кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов. Производные метана – метаниды, например, карбиды Ве2С и АlС3. Они разлагаются водой, выделяя метан: АlС3 + 12Н2О = 4Al(ОН)3 + 3СН4↑
Из солеподобных перкарбидов наиболее изучены ацетилиды типа М2+1С2, М+2С2 и М2+3(С2)3. Имеющий наибольшее значение ацетилид кальция СаС2 (называемый карбидом) получают нагреванием СаО с углем в электропечах:
СaO + 3C = CaC2 + CO
Ацетилиды более или менее легко разлагаются водой с образованием ацетилена:
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑
Эта реакция используется в технике для получения ацетилена.
Металлическими являются карбиды d-элементов IV–VIII групп. Чаще всего встречаются карбиды среднего состава МС (TiC, ZrC, HfC, VC, NbC, ТаС), М2С (Мо2С, W2С), М3С (Мn3С, Fe3С, Со3С). Металлические карбиды входят в состав чугунов и сталей, придавая им твердость, износоустойчивость и другие ценные качества. На основе карбидов вольфрама,титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов.
Соединения углерода (IV). Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллами: СНаl4, СОНаl2, СО2, COS, CS2 и анионных комплексах CO32–, COS22–, CS32–.
По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них взаимодействуют с водой, образуя кислоты:
СO2 + Н2O = Н2СО3
СOCl2 + 3Н2О = Н2СО3 + 2НCl
и с основными соединениями, образуя соли:
2КОН + СO2 = К2СО3 + Н2О
Из тетрагалогенидов CHal4 наибольшее применение получил тетрахлор метан СCl4 в качестве негорючего растворителя органических веществ, а также жидкости для огнетушителей. Его получают хлорированием сероуглерода в присутствии катализатора:
CS2 + Cl2 = CCl4 + S2Cl2
Смешанный фторид-хлорид углерода ССl2F2 – фреон (t кип. –30 °С) применяется в качестве хладагента в холодильных машинах и установках. Не ядовит. При попадании в атмосферу разрушает озоновый слой.
Дисульфид углерода или сероуглерод СS2 (ядовит) получают взаимодействием паров серы с раскаленным углем: C + 2S = СS2
Сероуглерод легко окисляется, при небольшом нагреве воспламеняется на воздухе: СS2 + 3O2 = CO2 + 2SO2
Все оксодигалогениды (карбонилгалогениды) COHal2 значительно более реакционноспособны, чем тетрагалогениды; в частности, они легко гидролизуются:
СОСl2 + Н2O = СO2 + 2НCl
Наибольшее применение находит СОCl2 (фосген, хлористый карбонил) – чрезвычайно ядовитый газ. Его широко используют в органическом синтезе.
Диоксид углерода CO2 (углекислый газ) в технике обычно получают термическим разложением СаСО3, а в лаборатории – действием на СаСО3 хлороводородной кислотой.
СаСО3 = CaO + CO2↑ СаСО3 + 2HCl = CaCl2 + CO2↑
Диоксид углерода легко поглощается растворами щелочей, при этом образуется соответствующий карбонат, а при избытке СО2 – гидрокарбонат:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3↓ + CO2 = Ca(HCO3)2
Гидрокарбонаты в отличие от карбонатов в большинстве своем растворимы в воде.
Растворимость CO2 в воде невелика, некоторая часть растворенного диоксида углерода взаимодействует с водой с образованием неустойчивой средней угольной кислоты Н2СО3 (триоксокарбонат водорода).
Сульфидокарбонаты (IV) (тиокарбонаты) во многом напоминают триоксокарбонаты (IV). Их можно получить взаимодействием сероуглерода с основными сульфидами, например:
К2S + СS2 = К2[СS3]
Водный раствор Н2СS3 – слабая тиоугольная кислота. Постепенно разлагается водой, образуя угольную кислоту и сероводород:
Н2СS3 + 3Н2О = Н2СО3 + 3Н2S
Из нитридокарбонатов важное значение имеет цианамид кальция СаСN2, получаемый окислением карбида кальция СаС2 азотом при нагревании:
СаС2 + N2 = СаСN2 + С
Из оксонитридокарбонатов водорода наибольшее значение имеет мочевина (карбамид) СО(NH2)2, получаемая действием СО2 на водный раствор аммиака при 130° С и 1∙107 Па:
СО2 + 2N3Н = СО(NH2)2 + Н2О
Мочевина применяется в качестве удобрения и для подкормки скота, как исходный продукт для получения пластических масс, фармацевтических препаратов (веронала, люминала и др.) и пр.
Сульфидонитридокарбонат (IV) водорода или тиоцианат водорода НSСN в водном растворе образует сильную (типа НCl) тиоцианистоводородную кислоту. Тиоцианиты в основном применяют при крашении тканей; NН4SСN используют как реактив на ионы Fe3+.
Соединения углерода (II). Производные углерода (II) – это СО, СS, HCN.
Оксид углерода (II) СО (угарный газ) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем.
СО2 + С ↔ 2СО
В молекуле СО имеется тройная связь, как в N2 и цианид-ионе CN–. В обычных условиях оксид углерода (II) химически весьма инертен. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии.
При нагревании СО окисляется серой, при облучении или в присутствии катализатора взаимодействует с хлором и т. д.
СО + S = СOS (оксосульфид углерода IV);
CO + Cl2 = СОCl2 (оксохлорид углерода IV)
Цианид водорода HCN имеет линейную структуру H–C≡N; существует также ее таутомерная форма (изоцианид водорода) H–N≡C. Водный раствор цианида водорода – очень слабая кислота, называемая синильной или цианистоводородной.
HCN – сильнейший неорганический яд.
Цианиды проявляют восстановительные свойства. Так, при нагревании их растворов они постепенно окисляются кислородом воздуха, образуя цианаты:
2KCN + O2 = 2KOCN
а при кипячении растворов цианидов с серой образуются тиоцианаты (на этом основано получение тиоцианатов):
2KCN + S = 2KSCN
Цианид водорода применяют в органическом синтезе, NаСN и КСN – при добыче золота, для получения комплексных цианидов и т. д.
При нагревании цианидов малоактивных металлов образуется дициан (СN)2 – очень реакционноспособный ядовитый газ.
Hg(CN)2 = Hg + (CN)2↑
 2015-01-30
2015-01-30 3590
3590
