Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь.
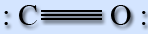
Две связи получены путем перекрывания неспаренных 2р-электронов углерода и кислорода, а треть – по донорно-акцепторному механизму за счет свободной атомной орбитали 2р углерода и электронной пары 2р кислорода. Молекула СО является донором электронной пары.
Физические свойства. Оксид углерода (II) – угарный газ, газ без цвета и запаха, легче воздуха, очень мало растворим в воде (2,32 мл в 100 г воды при 20 °C), растворим в
спирте и бензоле. Ткип = -192 °C; Тпл = -205 °C. Ядовит. Необратимо взаимодействует с гемоглобином крови.
Химические свойства. В химическом отношении – инертное вещество. Относится к несолеобразующим оксидам, не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты:
CO + NaOH = HCOONa,
что позволяет формально рассматривать его как ангидрид муравьиной кислоты.
Взаимодействие с кислородом. При нагревании в кислороде сгорает красивым синим пламенем:2СО + О2 = 2СО2.
Взаимодействие с водородом. Реагирует с водородом:СО + Н2 = С + Н2О.
 2015-01-30
2015-01-30 941
941








