| Пептидные гормоны | Стероиды | Производные аминокислот |
| Адренокортикотропный гормон (кортикотропин, АКТГ) | Альдостерон | Адреналин |
| Гормон роста (соматотропин, ГР, СТГ) | Кортизол | Норадреналин |
| Тиреотропный гормон (тиреотропин, ТТГ) | Кальцитриол | Трийодтиронин (Т3) |
| Лактогенный гормон (пролактин, ЛТГ) | Тестостерон | Тироксин (Т4) |
| Лютеинизирующий гормон (лютропин, ЛГ) | Эстрадиол | |
| Фолликулостимулирующий гормон (ФСГ) | Прогестерон | |
| Меланоцитстимулирующий гормон (МСГ) | ||
| Хорионический гонадотропин (ХГ) | ||
| Антидиуретический гормон (вазопрессин, АДГ) | ||
| Окситоцин | ||
| Паратиреоидный гормон (паратгормон, ПТГ) | ||
| Кальцитонин | ||
| Инсулин | ||
| Глюкагон |
Классификация гормонов по биологическим функциям*
| Регулируемые процессы | Гормоны |
| Обмен углеводов, липйдов, аминокислот | Инсулин, глюкагон, адреналин, кортизол, тироксин, соматотропин |
| Водно-солевой обмен | Альдостерон, антидиуретический гормон |
| Обмен кальция и фосфатов | Паратгормон, кальцитонин, кальцитриол |
| Репродуктивная функция | Эстрадиол, тестостерон, прогестерон, гонадотропные гормоны |
| Синтез и секреция гормонов эндокринных желёз | Тропные гормоны гипофиза, либерины и статины гипоталамуса |
| Изменение метаболизма в клетках, синтезирующих гормон | Эйкозаноиды, гистамин, секретин, гастрин, соматостатин, вазоактивный интестинальный пептид (ВИП), цитокины |
(*) Эта классификация условна, поскольку одни и те же гормоны могут выполнять разные функции
119. Строение, синтез и метаболизм иодтиронинов. Влияние на обмен веществ. Изменение метаболизма при гипо- и гипертиреозе. Причины и проявление эндемического зоба.
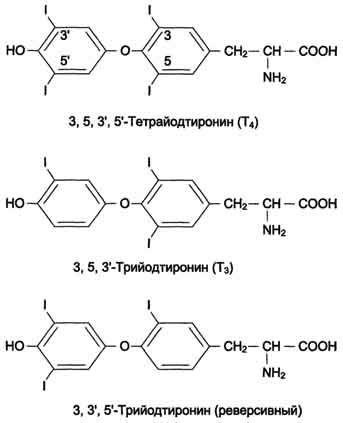
Биосинтез йодтиронинов. Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют собой морфологическую и функциональную единицу щитовидной железы.
Тиреоглобулин - гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8-10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2-1%
. 
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов. Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов
Транспорт йода в клетки щитовидной железы. Йод в виде органических и неорганических соединений поступает в ЖКТ с пищей и питьевой водой. Суточная потребность в йоде составляет 150-200 мкг. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в клетки щитовидной железы - энергозависимый процесс и происходит при участии специального транспортного белка против электрохимического градиента (соотношение концентраций I- в железе к концентрации I- в сыворотке крови в норме составляет 25:1). Работа этого йодид-переносящего белка сопряжена с Nа+,К+-АТФ-азой.
Окисление йода. Окисление I- в I+ происходит при участии гемсодержащей тиреоперокси-дазы и Н2О2 в качестве окислителя. Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойод-тирозинов (МИТ) и дийодтирозинов (ДИТ). Две молекулы ДИТ конденсируются с образованием йодтиронина Т4, а МИТ и ДИТ - с образованием йодтиронина Т3. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку путём эндоцитоза и гидролизуется ферментами лизосом с освобождением Т3 и Т4. В нормальных условиях щитовидная железа сек-ретирует 80-100 мкг Т4 и 5 мкг Т3 в сутки. Ещё 22-25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях по 5'-углеродному атому.
Транспорт и метаболизм йодтиронинов. От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме. Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 - 1-1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 - основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. В периферических тканях в результате дейодирования части Т4 по пятому углеродному атому образуется так называемая "реверсивная" форма Т3, которая почти полностью лишена биологической активности. Другие пути метаболизма йодтиронинов включают полное дейодирование, дезаминирование или декарбоксилирование. Йодированные продукты катаболизма йодтиронинов конъюгируют-ся в печени с глюкуроновой или серной кислотами, секретируются с жёлчью, в кишечнике вновь всасываются, дейодируются в почках и выделяются с мочой.
Механизм действия и биологические функции йодтиронинов. Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов - результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов. Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и, вероятно, обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке. При физиологической концентрации йодтиронинов их действие проявляется в ускорении белкового синтеза, стимуляции процессов роста и клеточной дифференцировки. В этом отношении йодтиронины - синергисты гормона роста. Кроме того, Т3 ускоряет транскрипцию гена гормона роста. У животных при дефиците Т3 клетки гипофиза теряют способность к синтезу гормона роста. Очень высокие концентрации Т3 тормозят синтез белков и стимулируют катаболические процессы, показателем чего служит отрицательный азотистый баланс. Метаболические эффекты йодтиронинов относят в основном к энергетическому метаболизму, что проявляется в повышении поглощения клетками кислорода. Этот эффект проявляется во всех органах, кроме мозга, РЭС и гонад. В разных клетках Т3 стимулирует работу Nа+,К+-АТФ-азы, на что затрачивается значительная часть энергии, утилизируемой клеткой. В печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот. В печени и жировой ткани Т3 повышает чувствительность клеток к действию адреналина и косвенно стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени. В физиологических концентрациях Т3 увеличивает в мышцах потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность мышечных клеток к действию адреналина. Йодтиронины также участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина.
Заболевания щитовидной железы Гормоны щитовидной железы необходимы для нормального развития человека.
Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития. Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса.
Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином " микседема " (от греч. туха - слизь, oedema -отёк). Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Избыток гликозаминогликанов вызывает изменения коллоидной структуры межклеточного матрикса, усиливает его гидрофильность и связывает ионы натрия, что приводит к задержке воды. Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. При возникновении гипотиреоза у детей старшего возраста наблюдают отставание в росте без задержки умственного развития. В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Гипотиреоз может быть также результатом недостаточного поступления йода в организм - эндемический зоб. Эндемический зоб (нетоксический зоб) часто встречается у людей, живущих в районах, где содержание йода в воде и почве недостаточно. Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается.
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза. Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит), потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических (катаболизм углеводов, ли-пидов и белков) процессов. В большей мере усиливаются процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс. Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодер-жащих препаратов, аутоиммунные реакции. Болезнь Грейвса возникает в результате образования антител к тиреоидным антигенам. Один из них, иммуноглобулин (IgG), имитирует действие тиреотропина, взаимодействуя с рецепторами тиреотропина на мембране клеток щитовидной железы. Это приводит к диффузному разрастанию щитовидной железы и избыточной неконтролируемой продукции Т3 и Т4, поскольку образование IgG не регулируется по механизму обратной связи. Уровень ТТГ при этом заболевании снижен вследствие подавления функции гипофиза высокими концентрациями йодтиронинов.
120. Регуляция энергетического метаболизма, роль инсулина и контринсулярных гормонов в обеспечении гомеостаза.
Основные пищевые вещества (углеводы, жиры, белки) окисляются в организме с освобождением свободной энергии, которая используется в анаболических процессах и при осуществлении физиологических функций. Энергетическая ценность основных пищевых веществ выражается в килокалориях и составляет: для углеводов - 4 ккал/г, для жиров - 9 ккал/г, для белков - 4 ккал/г. Взрослому здоровому человеку в сутки требуется 2000-3000 ккал (8000-12 000 кДж) энергии. При обычном ритме питания промежутки между приёмами пищи составляют 4-5 ч с 8-12-часовым ночным перерывом. Во время пищеварения и абсорбтивного периода (2-4 ч) основные энергоносители, используемые тканями (глюкоза, жирные кислоты, аминокислоты), могут поступать непосредственно из пищеварительного тракта. В постабсорбтивном периоде и при голодании энергетические субстраты образуются в процессе катаболизма депонированных энергоносителей. Изменения в потреблении энергоносителей и энергетических затратах координируются путём чёткой регуляции метаболических процессов в разных органах и системах организма, обеспечивающей энергетический гомеостаз. Основную роль в поддержании энергетического гомеостаза играют гормоны инсулин и глюкагон, а также другие контринсулярные гормоны - адреналин, кортизол, йодтиронины и соматотропин. Инсулин и глюкагон играют главную роль в регуляции метаболизма при смене абсорбтивного и постабсорбтивного периодов и при голодании. Абсорбтивный период характеризуется временным повышением концентрации глюкозы, аминокислот и жиров в плазме крови. Клетки поджелудочной железы отвечают на это повышение усилением секреции инсулина и снижением секреции глюкагона. Увеличение отношения инсулин/глюкагон вызывает ускорение использования метаболитов для запасания энергоносителей: происходит синтез гликогена, жиров и белков. Режим запасания включается после приёма пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Тип метаболитов, которые потребляются, депонируются и экспортируются, зависит от типа ткани. Главные органы, связанные с изменениями потока метаболитов при смене режимов мобилизации и запасания энергоносителей, - печень, жировая ткань и мышцы.
Изменения метаболизма в печени в абсорбтивном периоде
После приёма пищи печень становится главным потребителем глюкозы, поступающей из пищеварительного тракта. Почти 60 из каждых 100 г глюкозы, транспортируемой портальной системой, задерживается в печени. Увеличение потребления печенью глюкозы - не результат ускорения её транспорта в клетки (транспорт глюкозы в клетки печени не стимулируется инсулином), а следствие ускорения метаболических путей, в которых глюкоза превращается в депонируемые формы энергоносителей: гликоген и жиры. При повышении концентрации глюкозы в гепатоцитах происходит активация глюкокиназы, превращающей глюкозу в глюкозо-6-фосфат. Глюкокиназа имеет высокое значение Кm для глюкозы, что обеспечивает высокую скорость фосфорилирования при высоких концентрациях глюкозы. Кроме того, глюкокиназа не ингибируется глюкозо-6-фосфатом (см. раздел 7). Инсулин индуцирует синтез мРНК глюкокиназы. Повышение концентрации глюкозо-6-фосфата в гепатоцитах обусловливает ускорение синтеза гликогена. Этому способствуют одновременная инактивация гликогенфосфорилазы и активация гликогенсинтазы. Под влиянием инсулина в гепатоцитах ускоряется гликолиз в результате повышения активности и количества ключевых ферментов: глюкокиназы, фосфофруктокиназы и пируваткиназы. В то же время происходит торможение глюконеогенеза в результате инактивации фруктозо-1,6-бисфосфатазы и снижения количества фосфоенолпируваткарбоксикиназы - ключевых ферментов глюконеогенеза. Повышение концентрации глюкозо-6-фосфата в гепатоцитах в абсорбтивном периоде, сочетается с активным использованием NADPH для синтеза жирных кислот, что способствует стимуляции пентозофосфатного пути. Ускорение синтеза жирных кислот обеспечивается доступностью субстратов (ацетил-КоА и NADPH), образующихся при метаболизме глюкозы, а также активацией и индукцией ключевых ферментов синтеза жирных кислот. В абсорбтивном периоде в печени ускоряется синтез белков. Однако количество аминокислот, поступающих в печень из пищеварительного тракта, превышает возможности их использования для синтеза белков и других азотсодержащих соединений. Излишек аминокислот либо поступает в кровь и транспортируется в другие ткани, либо дезаминируется с последующим включением безазотистых остатков в общий путь катаболизма.
Изменения метаболизма в адипоцитах. Основная функция жировой ткани - запасание энергоносителей в форме триацилгли-церолов. Под влиянием инсулина ускоряется транспорт глюкозы в адипоциты. Повышение внутриклеточной концентрации глюкозы и активация ключевых ферментов гликолиза обеспечивают образование ацетил-КоА и глицерол-3-фосфата, необходимых для синтеза ТАГ. Стимуляция пентозофосфатного пути обеспечивает образование NADPH, необходимого для синтеза жирных кислот. Однако биосинтез жирных кислот de novo в жировой ткани человека протекает с высокой скоростью только после предшествующего голодания. При нормальном ритме питания для синтеза ТАГ используются в основном жирные кислоты, поступающие из ХМ и ЛПОНП под действием ЛП-липазы. Вместе с тем при увеличении отношения инсулин/глюкагон гормончувствительная ТАГ-липаза находится в дефосфорилированной неактивной форме, и процесс липолиза тормозится.
Изменение метаболизма в мышцах в абсорбтивном периоде. В абсорбтивном периоде под влиянием инсулина ускоряется транспорт глюкозы в клетки мышечной ткани. Глюкоза фосфорилируется и окисляется для обеспечения клетки энергией, а также используется для синтеза гликогена. Жирные кислоты, поступающие из ХМ и ЛПОНП, в этот период играют незначительную роль в энергетическом обмене мышц. Поток аминокислот в мышцы и биосинтез белков также увеличиваются под влиянием инсулина, особенно после приёма белковой пищи.
 2015-01-30
2015-01-30 1953
1953
