В потенциометрии раствор, содержащий определяемое вещество, активность (концентрацию) которого следует установить, и индикаторный электрод образуют полуэлемент; второй полуэлемент состоит из электрода сравнения. Потенциал индикаторного электрода Еинд линейно зависит от логарифма активности (концентрации) определяемого иона. Электрод сравнения в растворе постоянного состава имеет фиксированный потенциал Еср, не зависящий от состава анализируемого раствора. Оба электрода идеально неполяризуемые. Уравнение Нернста связывает потен-циал электрода и концентрацию соответствующего иона в растворе. Поэтому на основании измерения потенциала обратимого электрода можно рассчитать активность или концентрацию компонента раствора:
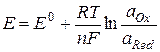 , , | (2.1) |
где E 0 – стандартный потенциал редокс-системы; R – универсальная газовая постоянная; T – температура, K; F – постоянная Фарадея; n – число электронов, принимающих участие в электродной полуреакции; aOx, aRed – активности соответственно окисленной и восстановленной форм редокс-системы.
Рассмотрим ячейку с индикаторным платиновым электродом, погруженным в раствор, содержащий ионы железа (II) и (III). Второй электрод (электрод сравнения) – насыщенный каломельный (н.к.э.). Наблюдаемая разность потенциалов составляет 0,395 В (25 оС). Рассчитаем процентное содержание железа (III).
Схема ячейки
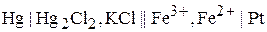
Потенциалы электродов определяются полуреакциями (всегда в форме реакций восстановления):
Fe3+ + e– = Fe2+, E 0 = 0,771 В (индикаторный электрод)
Hg2Cl2 + 2 e– = 2 Hg + 2 Cl–, Е 0 = 0,246 В (электрод сравнения)
Потенциал ячейки (ЭДС) Е описывается следующим уравнением (всегда из большего потенциала вычитают меньший):
Е = (Е Pt – Е н.к.э.) + Еj,
где Е Pt – потенциал индикаторного электрода; Е н.к.э. – потенциал насыщен-ного каломельного электрода; Еj – потенциал жидкостного соединения. Для минимизации Еj используют солевой мостик с насыщенным раствором соли, содержащей ионы с одинаковой подвижностью, например KCl. В правильно составленной потенциометрической ячейке потенциал электрода сравнения постоянен, а Еj постоянен или пренебрежимо мал.
Запишем выражения для потенциалов полуреакций:
E Pt = 
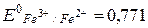 В; Е 0н.к.э. = 0,246 В
В; Е 0н.к.э. = 0,246 В
Е = Е Pt – E 0н.к.э. = 0,771 – 0,246 + 0,0591 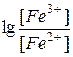
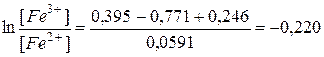
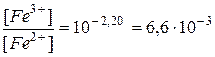
Это значит, что окислено 0,63% железа (II).
Для многих электродных систем расчет потенциалов по уравнению Нернста дает сильные отклонения от реальных значений. Это связано с тем, что стандартные потенциалы измерены (рассчитаны) для идеальных условий, тогда как для реальных невозможно определить активности или коэффициенты активностей. По этой причине используют величину, называемую формальным потенциалом:
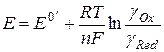 ,
,
где g – соответствующие коэффициенты активности. При подстановке в (2.1) уравнение Нернста будет иметь вид
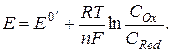
В этом случае состав раствора должен быть точно известен и соответ-ствовать условиям, при которых определен формальный потенциал.
 2015-01-30
2015-01-30 3100
3100








