Цель работы: определение количества НCl и H3BO3 в растворе при совместном присутствии методом кислотно-основного потенциометричес-кого титрования.
Сущность метода. Дифференциальное определение НCl и H3BO3 (в присутствии маннита или глицерина) основано на потенциометрическом титровании их 0,1 н. раствором щелочи до достижения pH раствора, отве-чающих конечным точкам титрования хлороводородной и борной кислот. Титрование проводят со стеклянным индикаторным электродом и насыщенным хлоридсеребряным электродом сравнения.
Константа диссоциации борной кислоты настолько мала (K дисс = 10–9), что сильная кислота в ее присутствии практически без осложнения может быть количественно оттитрована щелочью. По завершении титрования HCl титруют борную кислоту в присутствии глицерина (или маннита), с которым борная кислота образует комплексную одноосновную кислоту, имеющую бóльшую константу диссоциации (K дисс = 10–5). Таким образом, при последовательном титровании смеси кислот на кривой титрования наблюдается две точки эквивалентности: первая для соляной кислоты, а вторая для борной.
|
|
|
Оборудование: 1) рН-метр (порядок работы приведен в инструкции к прибору); 2) магнитная мешалка со штативом, на котором закреплены три бюретки (для растворов HCl, H3BO3 и NaOH); 3) ячейка (стакан на 150 см3); 4) стеклянный и хлоридсеребряный электроды; 5) кристаллизатор для промывания электродов; 6) цилиндры на 100см3 для воды и на 10 см3 для глицерина; 7) стакан для слива; 8) промывалка; 9) фильтровальная бумага.
Реактивы: 1) 0,1 н. раствор H3BO3 (6,1844 г/дм3, взвешивать на аналитических весах); 2) 0,1 н. раствор НCl (приготовленный из стандарт-титра); 3) 0,1 н. раствор NaOH (4,0 г/дм3, взвешивать на технических весах); 4) 0,5 н. раствор NaOH (20,0 г/дм3, взвешивать на технических весах); 5) глицерин.
Ход работы. Стандартизация раствора гидроксида натрия мето-дом потенциометрического титрования. Готовят ~ 0,1 н. раствор щелочи, определяют его концентрацию с точностью до четвертого знака после запятой.
Пипеткой отбирают 10,00 см3 0,1 н. раствора HCl и приливают в ячейку для титрования. Помещают в нее электроды, добавляют дистилли-рованную воду так, чтобы покрыть электроды (~40 см3), включают рН-метр и записывают показания прибора до начала титрования.
Заполняют бюретку приготовленным раствором NaOH и начинают титрование, приливая раствор NaOH порциями по 1,00 см3. Замеряют pH в каждой точке титрования, результаты записывают в таблицу (табл. 2.3). При добавлении некоторого количества титранта наблюдается резкий скачок величины рН (скачок титрования). Титрование продолжают до тех пор, пока рН раствора станет изменяться на 0,1 – 0,2 единицы рН при при-бавлении 1 см3 титранта (как правило, 5 – 6 см3 после скачка титрования).
|
|
|
Таблица 2.3
Кривая титрования раствора NaOH стандартным раствором HCl (V(HCl) = 10,00 см3; Сн(HCl) = 0,1000 моль/дм3)
| V(NaOH) | pH | DV | DpH | DpH/DV |
| … | … | … | … | … |
По данным табл. 2.3 построить график зависимости «рН – объем титранта» (рис. 2.6). Для нахождения точки эквивалентности можно пользоваться несколькими способами (приложение 2): графическим, методом Грана, методом графического дифференцирования.

Рис. 2.6. Кривая потенциометрического титрования
хлороводородной кислоты гидроксидом натрия
Одним из перечисленных методов определить точку эквивалент-ности и эквивалентный объем титранта Vэкв. Титрование повторяют до получения трех сходящихся результатов, при этом для каждого титрования строят свой график. Из трех определений находят средний объем 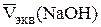 и рассчитывают концентрацию раствора NaOH с точностью до четырех значащих цифр:
и рассчитывают концентрацию раствора NaOH с точностью до четырех значащих цифр:
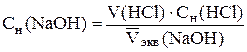 .
.
Определение концентрации борной кислоты. В ячейку наливают 10,00 см3 исследуемого раствора H3BO3, доливают 40 см3 дистиллирован-ной воды, погружают промытые электроды и мешалку, затем при хорошем перемешивании измеряют начальное значение pH раствора (pH1). Приливают 5 см3 глицерина и титруют, приливая по 0,5 см3 титранта до pH 11 – 11,3. Повторяют титрование для получения трех параллельных результатов, которые заносят в таблицу, аналогичную табл. 2.3. Строят кривые титрования и определяют эквивалентный объем NaOH 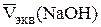 , рассчитывают средний объем из трех параллельных результатов и определяют концентрацию борной кислоты с точностью до четырех значащих цифр:
, рассчитывают средний объем из трех параллельных результатов и определяют концентрацию борной кислоты с точностью до четырех значащих цифр:

Учебная задача. Готовят смесь хлороводородной и борной кислот (по 10,00 см3 той и другой). Титруют ее порциями раствора NaOH по 0,5 см3 до завершения первого скачка титрования рН @ 9,0 – 9,3, соответ-ствующего взаимодействию NaOH с HCl. Добавляют 5 см3 глицерина и продолжают титрование до pH 11 – 11,3. При этом оттитровывается комплекс борной кислоты с глицерином (рис. 2.7).
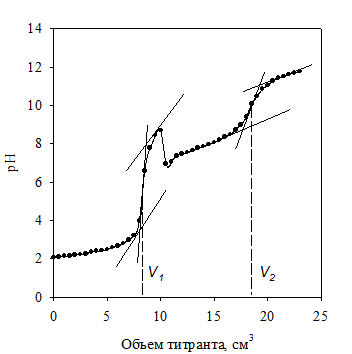
Рис. 2.7. Кривая потенциометрического титрования смеси хлороводородной и борной кислот раствором гидроксида натрия
Результаты заносят в таблицу, аналогичную табл. 2.3. Строят кривые титрования и определяют эквивалентные объемы NaOH для хлороводород-ной и борной кислот: V1(NaOH) = V1; V2(NaOH) = V2 – V1.
По трем параллельным результатам рассчитывают исходные объемы соляной и борной кислот с точностью до четырех значащих цифр:
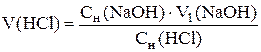

Контрольная задача. Получают контрольную задачу и путем титрования определяют объемы кислот известной концентрации.
 2015-01-30
2015-01-30 7181
7181







