При оценке качества вещества «1» в образцах одной серии значение рН раствора не отвечало требованиям ГФ - было менее 3,0. Дайте обоснование причинам изменения его качества по данному показателю в соответствии со свойствами. Предложите другие испытания, характеризующие его качество.
· Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
· В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций. Предложите общегрупповые и дифференцирующие реакции их обнаружения. Напишите уравнения реакций.
· Предложите методы количественного определения, приведите формулы для расчета содержания лекарственных веществ. Какие факторы внешней среды влияют на стабильность лекарственных средств? Предложите рациональные условия хранения и способы стабилизации в лекарственных формах.
| 1 | 2 | |
| Русское название | Папаверина гидрохлорид 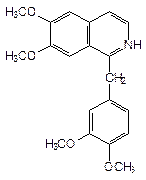 | Дротаверина гидрохлорид |
| Латинское название | Papaverine hydrochloride | Drotaverine hydrochloride |
| Рациональное название | 6,7-диметокси-1-(3',4'-диметоксибензил)-изохинолина гидрохлорид | 1-(3',4'-диэтоксибензилиден)-6,7-диэтокси-1,2,3,4-тетрагидро изохинолина гидрохлорид |
| Папаверин | Дротаверин |
| таблетки по 0,04 г в упаковке по 10 штук; 2 % раствор в ампулах по 2 мл; свечи по 0,2 г. | таблетки по 0,04 г в упаковке по 100 штук; 2 % раствор в ампулах по 2 мл (0,04 г) в упаковке по 5 или 50 ампул |
| Папаверин | Дротаверин | |
| - внешнего вида | Белый кристаллический порошок слегка горьковатого вкуса, без запаха.Может иметь желтый оттенок (по НД не допускается), т.к. легко окисляется. | Кристаллическое вещество светло-желтого или зеленовато-желтого цвета без запаха или почти без запаха. |
| - растворимости в воде | медленно растворим в воде (1:40) | Растворим в воде. |
| - «pH раствора»: | 3,0 - 4,5. В воде гидрохлорид подвергается гидролизу Þ кислая реакция среды. | |
| - «прозрачность раствора»: | ||
| - «цветность раствора» |
| Папаверин | Дротаверин | |
| Выделение основания | Добавление к раствору препарата раствора ацетата натрия приводит к выпадению осадка, его промывают, высушивают, определяют температуру плавления (145-147). | Добавление к раствору препарата раствора гидроксида натрия приводит к выпадению осадка, его промывают, высушивают, определяют температуру плавления (208-211). |
| Азотная кислота (конц.) | Желтое окрашивание, нагревание на водяной бане – оранжевое. | - |
| Серная кислота (конц.) | Фиолетовое окрашивание | В присутствиии следов хлорида железа (III) зеленое окрашивание, добавление азотной кислоты – коричнево-красное. |
| Реактив Марки | При последующем добавлении бромной воды и р-ра аммиака – фиолетовое окрашивание. | - |
| Реактив Фреде (р-р молибдата аммония в конц. серной кислоте) | Зеленое окрашивание. При обработке уксусным ангидридом и серной кислотой (конц) после нагревания на водяной бане – желтое окрашивание с зеленой флуоресценцией. | - |
| Реакция каролиновой пробы | При обработке уксусным ангидридом и серной кислотой (конц) после нагревания на водяной бане – желтое окрашивание с зеленой флуоресценцией. | - |
| Папаверин | Дротаверин |
| 1) метод неводного титрования в смеси муравьиной кислоты и уксусного ангидрида (инд-р кристаллический фиолетовый)2) метод нейтрализации в спиртовой среде (ф-ф)3) аргентометрия | 1) метод неводного титрования в смеси ледяной уксусной кислоты и ацетата ртути (II)2) метод нейтрализацииа) титрование в присутствии хлороформа (ф-ф)б) титрование в среде этанола3) метод обратной аргентометрии |
Дротаверин легко подвержен окислению (изменение окраски при окислении внешне не заметны).
4) Рациональные условия хранения:- по списку Б- в хорошо укупоренной таре- в защищенном от света месте 5) Способы стабилизации в ЛФ:- применение 0,1н. р-ра хлороводородной кислоты (в аптеке) для подкисления среды- использование комплексонов (ЭТДА и ее соли)- использование антиоксидантов (метионин, цистеин) Раствор папаверина г/х 2% - в составе содержатся ЭДТА и метионин - связывают ионы металлов. Это позволяет готовить препарат, который может храниться в течение 2-х лет. Ситуационная задача №При определении примеси «аминоантипирин» в одной серий анальгина по методике ГФ появилось оранжевое окрашивание. Дайте обоснование причинам изменения его качества по данному показателю в соответствии со свойствами. Предложите другие испытания, характеризующие его качество.
- Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
- В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
. Анальгин (метамизол-натрий),
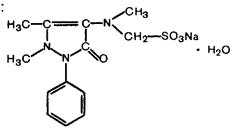 Analginum, 1-фенил-2,3-диметил-4-метиламинопиразолон-5 метансульфонат натрия
Analginum, 1-фенил-2,3-диметил-4-метиламинопиразолон-5 метансульфонат натрия
Фармакологическая группа: Ненаркотические анальгетики
Мед. применение: Обладает выраженным анальгезирующим, противовоспалительным и жаропонижающим действием. Применяют при болях различного происхождения (головная боль, невралгия, радикулиты, миозиты), лихорадочных состояниях, гриппе, ревматизме, хорее.
Характеристика химического строения: Анальгин можно рассматривать как производное пиразолина (частично гидрированной системы пиразола) или пиразолона-5, находящегося в форме иминоимида (таутомерная форма).
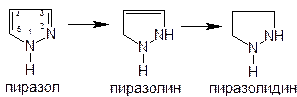
Препараты этой группы имеют 2 третичных атома азота и относятся к азотистым основаниям.
Анальгин обладает слабыми основными свойствами (наличие группировки =О). Электронная плотность азота в 1-ом положении оттянута на фенильный радикал и рядом стоящую карбонильную группу, поэтому азот в 1-ом положении проявляет слабые кислотные свойства. Во 2-ом положении - слабовыраженные основные свойства. Наличие основных свойств обусловливает образование окрашенных нерастворимых комплексных соединений с общеалкалоидными реактивами: например, с реактивом Люголя – бурый осадок; с реактивом Драгендорфа – оранжевые; с пикриновой кислотой – желтые и т.д. Реакции с общеалкалоидными реактивами неспецифичны, т.к. цвет комплексной соли не зависит от строения препарата и повторяет цвет реактива.
Анальгин проявляет восстановительные свойства, которые используют для выполнения ряда цветных реакций с окислителями и количественного определения окислительно-восстановительными методами. Ввиду наличия в молекуле остатка сульфита натрия метамизол-натрий образует водные растворы нейтральной реакции (на лакмус).
Вступает в SЕ реакции с галогенами благодаря неподеленной электронной паре у N1, которая вступает в сопряжение с π- электронной системой двойных связей (проявление ароматических свойств по положению С4).
Анальгин - белый кристаллический порошок или бесцветные кристаллы без запаха, горького вкуса. По ФС, ввиду его легкой окисляемости, допускается наличие желтого оттенка, препарат очень легко разлагается (соответствующие условия хранения). Легко растворим в воде, трудно – в этаноле, практически нерастворим в эфире и хлороформе (ввиду наличия гидрофильной группы в молекуле). Для анальгина определение температуры плавления не регламентировано (соль). Анальгин - соль сильной кислоты и сильного основания - рН = 6-7,5. Значения рН - обязательный показатель качества. Поглощает в УФ-области, имеет специфические ИК-спектры.
2. Подлинность:
1) Реакции окисления
а) + FeCl3
Образуются продукты окисления, окрашенные в синий цвет, переходящий в зеленый, желтый и, наконец, обесцвечивается со временем.
б) + NaNO2
Образуется зеленовато-синее исчезающее окрашивание с выделением газа.
в) + AgNO3
Сначала приобретает сине-фиолетовое окрашивание, затем выпадает серовато-коричневый осадок серебра.
г) + K3[Fe(CN)6]
K3[Fe(CN)6] ® K4[Fe(CN)6] + FeCl3 - берлинская лазурь
2) Кислотный гидролиз с последующим доказательством продукта
Нагревание на водяной бане с минеральными кислотами - выделяется диоксид серы и формальдегид, которые обнаруживают по запаху:
После охлаждения прибавляют раствор хлорида железа (III), через 2 мин появляется темно-красное окрашивание.
Идентификация СН2О: реакцию выполняют в присутствии концентрированной серной и салициловой кислот – образуется (за счет выделяющегося формальдегида) ауриновый краситель, имеющий интенсивное красное окрашивание.
Идентификация SO2: окисление раствором йодата калия в присутствии хлороводородной кислоты – малиновое окрашивание, которое усиливается от избытка реактива, а потом выделяется бурый осадок йода.
5 SO2 + 2 KIO3 → 4 SO3 + I2 + K2SO4
3) Окисление со свежеприготовленным раствором хлорной извести в присутствии H2SO4 – голубое корашивание, переходящее в зеленое, затем в желтое.
4) На ион Na+
Микрокристаллоскопическая реакция с пикриновой кислотой
5) На серу
Метамизол-натрия пркаливают в смеси карбонатов натрия и калия в течение 10 мин. Плав охлаждают, растворяют в азотной кислоте и фильтруют. Образовавшиеся сульфат-ионы обнаруживают с помощью раствора хлорида бария
6) ИК- и УФ-спектрофотометрия.
НД рекомендует подтверждать подлинность по ИК-спектрам, снятым в виде спрессованных таблеток лекарственных веществ с бромидом калия в области 4000 – 400 см-1, которые должны полностью совпадать с прилагаемыми к ФС рисунками спектров.
УФ-спектроскопия водных растворов метамизола-натрия: λmax = 237 и 270 нм; растворов в этаноле: λmax = 236,5 и 264,5 нм.
1) Йодометрия
Выполняют методом прямого титрования йодом в слабокислой вводно-спиртовой среде (до окисления S(IV) в S(VI)):
S+4 – 2e → S+6
Конечную точку титрования можно определить по избытку титрованного раствора йода (желтое окрашивание).
2) + НClO4
Хранение. Список Б. Анальгин (метамизол-натрий) очень чувствителен к действию света и влаги, поэтому его хранят в хорошо укупоренных банках оранжевого стекла. Пожелтение метамизола-натрия при хранении (особенно в водных растворах) связано с воздействием температуры, кислорода, света, воздуха, процессом гидролиза и др. При этом могут образовываться примеси 4-оксиаминофеназона, N’,N’-метиленбисаминофеназона, 4-метиламинофеназона.
 2015-01-30
2015-01-30 2585
2585
