Фармацевтическая организация - дистрибьютор закупила таблетки фенобарбитала и бензонала. В целях исключения возможной фальсификации Вам необходимо установить подлинность действующих веществ в таблетках и оценить их качество.
• Приведите химические формулы фенобарбитала и бензонала, охарактеризуйте химическое строение каждого из них.
• Обоснуйте возможность использования физико-химических свойств для оценки качества, приведите нормативные показатели. Предложите групповые и дифференцирующие реагенты для установления подлинности каждого из них, обоснуйте условия проведения реакций.
• Обоснуйте возможные методы количественного определения в субстанции и таблетках, приведите расчетные формулы.
Фенобарбитал – Phenobarbitalum
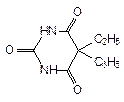 5-этил-5-фенилбарбитуровая кислота;
5-этил-5-фенилбарбитуровая кислота;
5-этил-5-фенил-2,4,6(1н,3н,5н)-пиримидинтрион
Бензонал – Benzonalum (бензобарбитал)
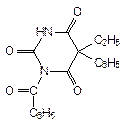 1-бензоил-5-этил-5-фенилбарбитуровая кислота;
1-бензоил-5-этил-5-фенилбарбитуровая кислота;
1-бензоил-5-этил-5-фенил-2,4,6 (1н, 3н, 5н)-пиримидинтрион
Фармакологическая группа: Противосудорожные средства
Мед. применение:
Фенобарбитал. Чаще применяется как противоэпилептическое средство; как снотворное средство при расстройствах сна; в малых дозах оказывает успокаивающее действие и в сочетании с другими препаратами (спазмолитики, сосудорасширяющие средства) находит применение при нейровегетативных расстройствах.
Бензонал. Подобно фенобарбиталу обладает противосудорожной (противоэпилептической) активностью, но оказывает менее выраженный гипноседативный эффект. Применяют для лечения судорожных форм эпилепсии различного происхождения. В сочетании с гексамидином, карбамазепином, дифенином и другими противоэпилептическими препаратами бензонал используют для лечения бессудорожных и полиморфных припадков. Также применяют для лечения гипербилирубинемий.
Химический класс соединений: гетероциклические соединения,
производные пиримидина
производные барбитуровой кислоты
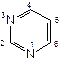
В основе химической структуры лекарственных веществ данной группы лежит 2,4,6-триоксопроизводное пиримидина, или кислота барбитуровая. Кислоту барбитуровую можно рассматривать также как циклический уреид, образованный мочевиной и двухосновной кислотой малоновой.
Поскольку в результате конденсации образуется замкнутая циклическая система с 2-мя атомами азота (в положении 1 и 3), то барбитураты рассматривают как производные пиримидина. Пиримидин - гетероциклическая структура с двумя атомами азота в положении 1 и 3. Проявляет слабые основные свойства.
Барбитураты (фенобарбитал и бензонал) являются не солями барбитуровой кислоты, а замещеннми по 5-му положению производными (протон в положении 5 подвижен). Подвижность протонов в 5-ом положении связана с перераспределением электронной плотности на рядом стоящие кислороды в 4-м и 6-м положении, что дает возможность существования барбитуровой кислоты в енольной форме:
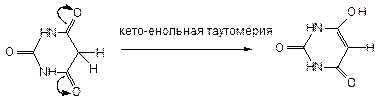
Барбитураты способны проявлять лактим-лактамную таутомерию (за счет водородов имидных групп):
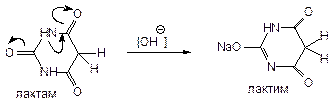
Фенобарбитал и бензонал находятся в лактамной форме.
Фенобарбитал: радикал в положении С5 R1 = R2 = - C2H5.
Бензонал: радикал в положении С5 R1 = - C2H5; R2 = С6Н5;
в положении N1 R3 = - C(О)-С6Н5.
2. Барбитураты – белые кристаллические порошки без запаха. УФ-спектры барбитуратов в области 220-280 нм имеют максимумы и минимумы поглощения, используемые для идентификации. Раствор фенобарбитал в этаноле после добавления буферного раствора с рН 10 имеет максимум поглощения при 240 нм и минимум при 224 нм. Бензонал (раствор в этаноле и 0,1М растворе НCl) в области 220-350 нм имеет максимум при 257 нм и минимум при 230 нм.
Групповые реагенты:
1) комплексообразование с солями тяжелых металлов (кобальта, меди, серебра).
Условия: в реакцию барбитураты должны вступать только в ионном виде; реакция среды – нейтральная или слабощелочная.
Условия имеют важное значение, т.к. это очень слабые кислоты и их соли легко подвергаются гидролизу. Реакция среды водного раствора натриевой соли барбитуратов будет щелочная (определяется по фенолфталеину) Þ гидролиза не должно быть. Для этого иногда используется спирт:
а) С солями Со3+: навеска + спирт + CаCl2 (для повышения устойчивости комплекса) + реактив Co(NO3)3 или CoCl3 + раствор NaOH (для кислотных форм) → сине-фиолетовое окрашивание раствора.
б) С CuSO 4 (реакция общегрупповая, но находит применение для идентификации отдельных представителей): навеску растворить в воде + карбонатный буфер (КНСО3 и К2СО3) (для сохранения реакции среды) + реактив CuSO4.
Фенобарбитал – осадок бледно-сиреневого цвета, не изменяющийся пристоянии;
Бензонал – серо-голубое окрашивание, переходящее в ярко-синее, затем выпадает белый осадок.
в) С солями серебра (образование моно- и дизамещенной соли). Моносеребряные соли растворимы в воде, дисеребряные – нет.
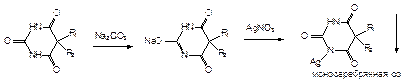
В избытке реактива моносеребрянная соль растворяется Þ образуется натриево-серебрянная соль:
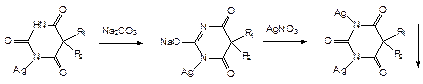
Бензонал, имеет заместителя в первом положении и образует монозамещенную серебряную соль, не растворимую в воде:
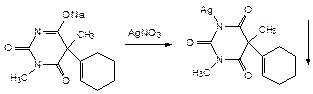
2) Конденсация с альдегидами.
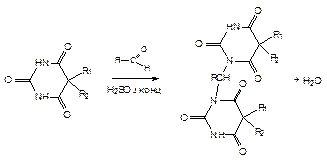
При правильном выборе альдегида эту реакцию можно использовать для идентификации, т.к. различные барбитураты будут давать разный результат. Например, фенобарбитал + формалин Þ образует вишнево-красное кольцо на границе водного слоя и слоя конц. H2SO4. Эта реакция часто используется в методе ТСХ; в качестве детергента используется раствор альдегида + конц. H2SO4 Þ на ТСХ пятна барбитуратов окрашиваются в характерные цвета.
3) Способность к гидролитическому разложению.
Барбитураты - достаточно нестойкие соединения и при хранении подвергаются гидролитическому расщеплению:
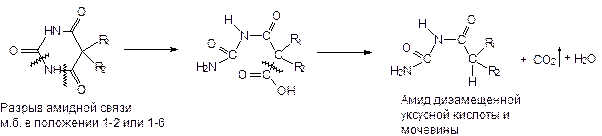
При гидролизе образуются уровые кислоты (+амид дизамещенной уксусной кислоты и мочевины). И особенно легко эта реакция идет в присутствии щелочи.
В более жестких условиях:
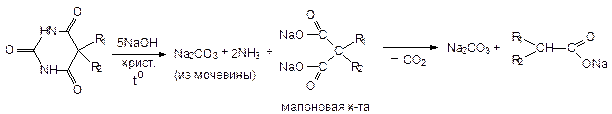
Эту реакцию можно использовать для идентификации, т.к. выделяется аммиак (запах, лакмус) + после подкисления - кислота будет обладать характерным запахом, а из карбонатов будет выделять углекислый газ. Также эта реакция показывает строение барбитуратов, их принадлежность к классу уреидов и те возможные изменения, которые могут возникать в процессе хранения. Как аналитическая реакция не используется.
4) + Н2SO4 + K2Cr2O7: появляется стойкое зеленое окрашивание
5) с раствором щелочи – растворение с образованием натриевых и динатриевых солей.
 2015-01-30
2015-01-30 4898
4898








