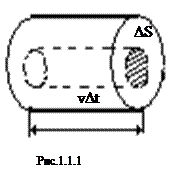
 Для вывода этого уравнения предположим, что в сосуде находится идеальный газ. Молекулы газа соударяются друг с другом и со стенками сосуда. Соударения молекул друг с другом приводят только к перераспределению энергии между молекулами. Выделим некоторую элементарную площадку на стенке сосуда и рассчитаем давление газа на нее (Рис.1). При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс
Для вывода этого уравнения предположим, что в сосуде находится идеальный газ. Молекулы газа соударяются друг с другом и со стенками сосуда. Соударения молекул друг с другом приводят только к перераспределению энергии между молекулами. Выделим некоторую элементарную площадку на стенке сосуда и рассчитаем давление газа на нее (Рис.1). При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс 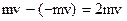 , где m - масса молекулы, v - ее скорость. За время Dt площадки DS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием DS и высотой vDt. Если n - концентрация молекул, то число этих молекул - nDSvDt. Однако следует учесть, что молекулы движутся к площадке DS под разными углами и с различными скоростями. Поскольку движение молекул хаотическое, то его можно заменить движением вдоль трех взаимно перпендикулярных направлений. К тому же поскольку ни одно из направлений не имеет преимуществ перед другими, то в любой момент времени вдоль каждого из них движется 1/3 всех молекул, причем половина из них, т.е. 1/6 в одну сторону, другая половина - в противоположную. Тогда за время Dt площадку DS достигнет число молекул, равное
, где m - масса молекулы, v - ее скорость. За время Dt площадки DS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием DS и высотой vDt. Если n - концентрация молекул, то число этих молекул - nDSvDt. Однако следует учесть, что молекулы движутся к площадке DS под разными углами и с различными скоростями. Поскольку движение молекул хаотическое, то его можно заменить движением вдоль трех взаимно перпендикулярных направлений. К тому же поскольку ни одно из направлений не имеет преимуществ перед другими, то в любой момент времени вдоль каждого из них движется 1/3 всех молекул, причем половина из них, т.е. 1/6 в одну сторону, другая половина - в противоположную. Тогда за время Dt площадку DS достигнет число молекул, равное 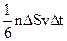 . При столкновении с площадкой DS эти молекулы передадут ей импульс
. При столкновении с площадкой DS эти молекулы передадут ей импульс
|
|
|
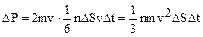
 Тогда давление, оказываемое газом на стенку сосуда, равно
Тогда давление, оказываемое газом на стенку сосуда, равно

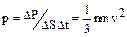 . (1.1.1)
. (1.1.1)
Как уже отмечалось выше, молекулы движутся с различными скоростями v1, v2,…, vn, если в объеме V газа содержится N молекул, то вместо скорости v необходимо учитывать среднюю квадратичную скорость
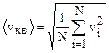
Тогда уравнение (1.1.1) запишется в виде
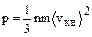
 (1.1.2)
(1.1.2)
Уравнение (1.1.2) называют основным уравнением кинетической теории идеальных газов.
|
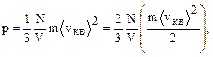 |
Поскольку концентрация n=N/V, следовательно
или 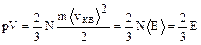 ,
,
где áЕ ñ- средняя кинетическая энергия одной молекулы, Е - кинетическая энергия газа.
Давление пропорционально числу молекул в единице объема и среднему значению кинетической энергии молекул.
Из основного уравнения можно вывести все газовые законы, установленные экспериментально еще в XVIII столетии, для данной массы газа справедливы законы:
Бойля-Мариотта PV=const, при T=const;
Гей-Люссака 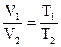 при р=const и
при р=const и 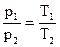 при V=const;
при V=const;
Дальтона p=p1+p2+…+pn;
Для 1 киломоля идеального газа справедлива формула Клапейрона-Менделеева
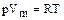 , (1.1.4)
, (1.1.4)
где R=8,314 Дж/(мольК) - универсальная газовая постоянная. Для одного моля газа N=NA=6,02×1023 - число Авагадро. Следовательно, число Авогадро это число молекул в моле любого вещества. Количество молекул газа при нормальных условиях (p=1,013€10-5 Па, T=273°K), находящихся в единице объема (1м2), называется числом Лошмидта NL=2,687×10 25м-3. Оно равняется числу Авогадро, деленному на объем моля газа при нормальных условиях Vm=22,41×10-3м3×моль-1
|
|
|
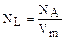
Сравнивая выражения (1.1.3) и (1.1.4), получаем

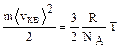
С учетом постоянной Больцмана (k=R/NA=1,38×10-23Дж/K):

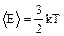 (1.1.5)
(1.1.5)
Мы получили соотношение, связывающее среднюю кинетическую энергию одной молекулы с температурой.
Температура - физическая величина, характеризующая состояние равновесия термодинамической системы и пропорциональная средней кинетической энергии хаотического движения частиц, составляющих систему.
При приведении в контакт веществ, с различными температурами, т.е. кинетическими энергиями частиц, имеет место теплообмен - выравнивание температур.
Для измерения температуры используют зависимость физических свойств веществ от температуры (контактную разность потенциалов, тепловое расширение, зависимость электрического сопротивления, излучательную способность и т.д.).
Из уравнения (1.1.4) можно рассмотреть связь между температурой, давлением и объемом для заданной массы идеального газа
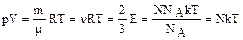 ,
,
где m - масса газа,
m - молярная масса газа,
n - число молей,
N- число молекул в данном объеме газа.
Поскольку для двух различных состояний одной массы газа p1V1=NkT1 и p2V2=NkT2, имеем 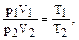 т.е.
т.е. 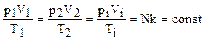 (1.1.6)
(1.1.6)
Термодинамическая температура прямо пропорциональна произведению объема на давление (для заданной массы газа).
В качестве примера применения уравнения Менделеева - Клапейрона рассмотрим процесс изменения температуры и давления при постоянном объеме V=const (изохорический процесс). В этом случае удобно воспользоваться зависимостью давления от плотности и температуры
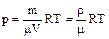 , (1.1.7)
, (1.1.7)
где r=m/m - плотность газа (кг/м3).
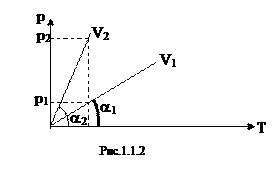
|
Пример 1. Определить температуру, при которой 4м2 газа создают давление 1,5×105 Па, если при нормальных условиях газ занимает объем 5м3.
Решение. В нормальных условиях V1=5 м3, р1=1атм=101325 Па, Т1=273°К, необходимо найти Т2 при V2=4м3, р2=1,5×105 Па. Согласно (5) имеем
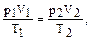 откуда
откуда 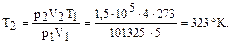
Пример2. Сколько молекул вы вдыхаете, если при одном вдохе получаете 1л воздуха?
Решение. Объем одного киломоля равен 22,4м3, значит 1л воздуха равен 1×10-3/22,4=4,5×10-5кмоль. Таким образом, 1л воздуха содержит 4,5×10-5×6,02×1026=2,7×1022 молекул.
Пример3. Что тяжелее 1м3 сухого воздуха или 1м3 влажного воздуха при одинаковых температурах и давлениях? mвозд.=29 кг/кмоль, mводы=18 кг/кмоль.
Решение. Средняя масса молекулы сухого воздуха больше, чем у водяного пара. Число молекул в обоих случаях одинаково, но во влажном воздухе часть молекул заменена более легкими молекулами воды, следовательно, 1м3 сухого воздуха тяжелее, чем 1м3 влажного.
Пример4. Как изменится давление данной массы газа при постоянном объеме, если температуру газа увеличить в 2 раза и каждая молекула при этом распадется на два атома?
Решение. 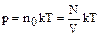 , так как N и T увеличиваются в 2 раза, то давление увеличится в 4 раза.
, так как N и T увеличиваются в 2 раза, то давление увеличится в 4 раза.
Пример5. Показать, что 
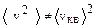 .
.
Решение. Рассмотрим четыре молекулы, скорости которых различны и равны 1,2,3 и 4м/c. Квадрат среднего значения 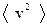 равен
равен
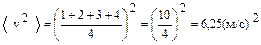 ,
,
а средняя квадратичная скорость равна
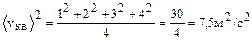 .
.
Если скорости отдельных молекул равны +1, -2, -3, +4 м/c, то 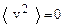 , а
, а 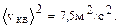

 2015-01-30
2015-01-30 2327
2327
