Задача этого раздела аналитической химии – определение количественного содержания отдельных элементов в соединениях (или отдельных веществ в смесях). С помощью количественного анализа находят массовые соотношения между элементами в соединениях, определяют количество растворенного вещества в определенном объеме раствора, иногда узнают процентное содержание какого-нибудь элемента в однородной смеси веществ.
В сельскохозяйственной практике чаще всего определяют содержание того или иного компонента в неоднородных веществах; например: азота, оксида фосфора (V) или оксида калия – в азотных, фосфорных или калийных удобрениях, микроэлементов - в почве, сахаров – в растительном материале. Количественный анализ имеет большое значение для биологии и агрохимии, почвоведения, физиологии растений.
Пример 1. На титрование 22 мл раствора гидроксида натрия
(Т 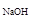 = 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты.
= 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты.
Решение. Находим молярную концентрацию эквивалентов гидроксида натрия в растворе по формуле:
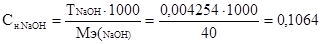 н.,
н.,
где М  =
= 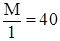 г/моль.
г/моль.
Так как затрачиваемые на титрование объемы растворов обратно пропорциональны их молярным концентрациям эквивалентов веществ, следовательно 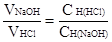 , отсюда
, отсюда
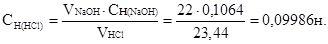
Титр раствора хлороводородной кислоты

где Мэ(НСl) = 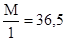 г/моль.
г/моль.
Пример 2. На титрование 0,4080 г карбоната калия затрачено 40,60мл раствора серной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов серной кислоты.
Решение. По закону эквивалентов 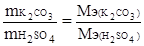 ;
;
отсюда 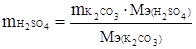 .
.
Найдем молярные массы эквивалентов
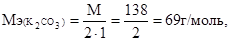
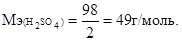
Подставляем эти значения в формулу и находим

Такое количество кислоты содержится в 40,60 мл раствора, следовательно

Молярную концентрацию эквивалентов серной кислоты рассчитываем по формуле:
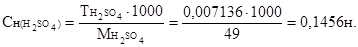
Пример 3. В 200 мл раствора содержится 0,6975 г сульфата железа(II). На титрование 20 мл этого раствора в присутствии серной кислоты израсходовано 22мл раствора перманганата калия. Рассчитайте молярную концентрацию эквивалентов и титр раствора перманганата калия.
Решение. При титровании раствора сульфата железа (II) раствором перманганата калия происходит следующая окислительно-восстановительная реакция
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
окислитель восстановитель


 Mn+7 + 5ē = Mn+2 1 2 - восстановление
Mn+7 + 5ē = Mn+2 1 2 - восстановление
5 x 2
Fe+2 - 1ē = Fe+3 5 10 - окисление
Находим молярную концентрацию эквивалентов сульфата железа (II) по формуле 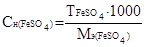 , где
, где
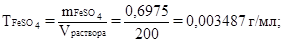

Следовательно, молярная концентрация эквивалентов сульфата железа(II) равна 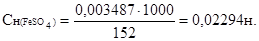
Исходя из соотношения: 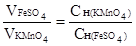 вычисляем молярную концентрацию эквивалентов перманганата калия
вычисляем молярную концентрацию эквивалентов перманганата калия
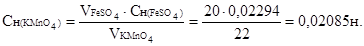
Титр раствора перманганата калия рассчитываем по формуле:
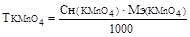 , где
, где

следовательно, 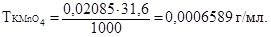
 2015-01-30
2015-01-30 547
547








