Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. Наиболее существенными теоретическими вопросами являются учение о химическом равновесии и теория растворов. Реакции аналитической химии в своем большинстве обратимы и для того чтобы при обратимой реакции достичь возможно более полного превращения одного из взятых веществ, необходимо действовать избытком того реагента, который вызывает это превращение.
Реакции, применяемые в аналитической химии, протекают чаще в водных растворах, поэтому в аналитической химии очень важно: а) знать, в какой мере различные электролиты распадаются в растворе на ионы;
б) определять, как изменяются концентрации тех или иных ионов в растворе при введении в него электролита с одноименным ионом; в) уметь рассчитывать концентрации катионов H+, гидроксид - ионов OH-, определять pH растворов.
Выполняя такие важные аналитические операции, как осаждение или отделение ионов, промывание и растворение осадков, имеют дело с гетерогенными системами. В гетерогенных системах может наступить равновесие «насыщенный раствор - осадок», но оно может быть смещено как в сторону образования осадка, так и в сторону его растворения. Условием образования осадка является превышение произведения концентраций ионов труднорастворимого электролита (ионного произведения – ИП) над его произведением растворимости (ИП>ПР). Условием растворения осадка является понижение ИП по отношению к значению ПР (ИП< ПР).
Исходя из значений ПР, можно рассчитать растворимость труднорастворимых веществ в воде и в растворах, содержащих другие электролиты. Растворимостью данного вещества называется концентрация вещества в определенном объеме его насыщенного раствора. Различают молярную растворимость в моль/л (S) и растворимость в г/л (P), которые связаны между собой следующей зависимостью: P = S × M, где M-молярная масса труднорастворимого вещества.
Пример 1. Произведение растворимости оксалата бария ВаС2О4 при 20°С равно 1,62×10-7. Вычислите растворимость соли (в моль/л и г/л) при указанной температуре.
Решение. В насыщенном растворе труднорастворимого электролита ВаС2О4 существует равновесие:
ВаС2О4 Û Ва2+ + С2О42 -
в осадке в растворе
При растворении каждого моля ВаС2О4 в раствор переходят 1 моль ионов Ва2+ и 1 моль ионов С2О42 - . Обозначим растворимость соли
S моль/л, тогда в насыщенном растворе ВаС2О4 концентрации ионов будут равны: [Ва2+ ] = S моль/л, [С2О42 - ] = S моль/л.
Отсюда, 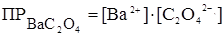 = S×S = S2.
= S×S = S2.
Выразим растворимость: S = 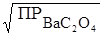
Подставив числовое значение 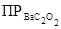 = 1,62×10-7, находим молярную растворимость соли в моль/л: S =
= 1,62×10-7, находим молярную растворимость соли в моль/л: S = 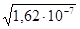 = 0,4 ×10-3 моль/л.
= 0,4 ×10-3 моль/л.
М 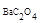 = 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л.
= 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л.
Пример 2. Растворимость фосфата серебра в воде при t=250C равна 6,15×10-3 г/л. Вычислите произведение растворимости данной соли.
Решение. Молярная растворимость фосфата серебра (S моль/л) равна S = 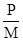 , где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно,
, где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно,
S= 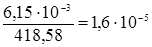 моль/л.
моль/л.
В насыщенном растворе фосфата серебра существует равновесие:
Ag3PO4 Û 3Ag+ + PO43-
в осадке в растворе
При растворении каждого моля Ag3PO4 в раствор переходят 3 моль ионов Ag+ и 1 моль ионов РО43-. Так как молярная растворимость фосфата серебра S = 1,6×10-5 моль/л, то концентрации ионов в насыщенном растворе соответственно равны:
[Ag+] 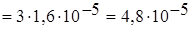 моль/л,[PO43-]
моль/л,[PO43-] 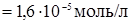 .
.
Запишем выражение для произведения растворимости фосфата серебра и вычислим его значение:
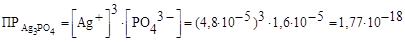
Пример 3. Произведение растворимости сульфида магния при t = 250С равно 2,0×10-15. Образуется ли осадок MgS при смешении равных объемов 0,002М раствора нитрата магния и 0,0003М раствора сульфида натрия.
Решение. При смешении растворов нитрата магния и сульфида натрия протекает следующая реакция: Mg(NO3)2 + Na2S = MgS + 2NaNO3
Для образования осадка MgS необходимо, чтобы ИП > ПРMgS.
При смешении равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов, следовательно, концентрации растворенных веществ уменьшаются вдвое, т.е.
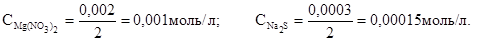
Нитрат магния и сульфид натрия как сильные электролиты, в водных растворах диссоциируют практически полностью:
Mg(NO3)2 ® Mg2++ 2NO3 -
Na2S ® 2Na+ + S 2-
Из уравнений диссоциации следует, что из одного моля нитрата магния и одного моля сульфида натрия образуется по одному молю соответственно ионов Mg2+ и S 2 -.
Поэтому концентрация ионов Mg2+ и S 2– равна концентрации соответствующей соли в общем растворе:
C Mg2+ = C Mg(NO3)2 = 0,001 моль/л; СS 2 - = СNa2S = 0,00015 моль/л.
Рассчитаем произведение концентраций ионов (ИП) и сравним его со значением произведения растворимости для сульфида магния:
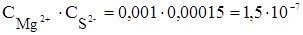 .
.
Так как 1,5×10-7 > 2,0×10-15, значит ИП >ПРMgS, и осадок MgS образуется.
Пример 4. Вычислите рН 0,0042М раствора гидроксида калия.
Решение. Гидроксид калия – электролит сильный, практически полностью диссоциирует на ионы КОН ® К+ + ОН -, поэтому концентрация гидроксид ионов в растворе равна концентрации гидроксида калия:
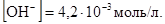
Зная, что ионное произведение воды KH2O = 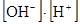 = 10-14, можно найти концентрацию катионов водорода:
= 10-14, можно найти концентрацию катионов водорода:
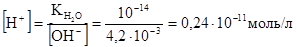
Отсюда 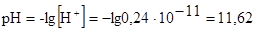 .
.
Пример 5. Вычислите рН 0,2 М раствора уксусной кислоты.
Решение. 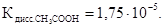 Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
СН3СООН Û Н+ + СН3СОО -
Запишем выражение константы диссоциации:
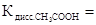
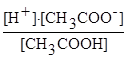 ;
;
По уравнению диссоциации делаем вывод, что на каждый образующийся H+- ион приходится один CH3COO - -ион, значит [H+]=[CH3COO - ]. Концентрацию недиссоциированных молекул слабой кислоты можно принять равной концентрации раствора кислоты. Следовательно, 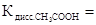
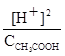
Отсюда:
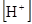 =
= 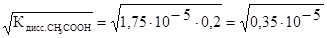 = 1,9×10-3 моль/л.
= 1,9×10-3 моль/л.
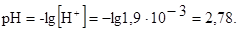
Пример 6. Во сколько раз изменится растворимость карбоната кальция СаСО3 в 0,1М растворе карбоната калия К2СО3 по сравнению с растворимостью его в воде? Произведение растворимости 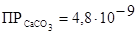 .
.
Решение. Рассчитаем растворимость СаСО3 в воде – S (моль/л):
СаСО3 Û Са2+ + СО32 -
в осадке в растворе
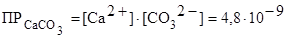 .
.
Обозначим растворимость СаСО3 равной S моль/л, тогда согласно уравнению диссоциации карбоната кальция в насыщенном растворе концентрация каждого из его ионов равна S моль/л.
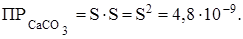 Следовательно, растворимость СаСО3 в воде будет равна:
Следовательно, растворимость СаСО3 в воде будет равна:
S = 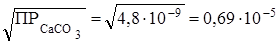 моль/л.
моль/л.
Найдем растворимость СаСО3 в 0,1М растворе К2СО3. При введении сильного электролита, диссоциирующего по уравнению:
К2СО3 ® 2К+ + СО32 - , концентрация карбонат - ионов СО32 - повышается на 0,1 моль и становится равной (S + 0,1) моль/л, а концентрация катионов кальция остаётся равной S моль/л, тогда:
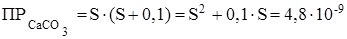 .
.
Так как значение S2 много меньше произведения 0,1× S, то величиной S2 можно пренебречь и тогда:
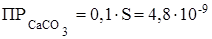 .
.
Отсюда, растворимость СаСО3 в 0,1М растворе К2СО3 будет равна:
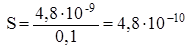 моль/л, и следовательно, уменьшится в
моль/л, и следовательно, уменьшится в 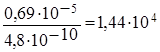 раз.
раз.
Буферные растворы (смесь слабой кислоты с ее солью или смесь слабого основания с его солью) широко распространены в природе и очень часто используются в химической практике, в том числе и при химическом анализе. В отличие от растворов кислот и оснований буферные растворы обладают важными свойствами:
1. рН буферных растворов практически не зависит от разбавления. Это обусловлено тем, что буферные растворы - это растворы слабых кислот или оснований с подавленной степенью диссоциации. Подавление степени диссоциации - результат присутствия в этих растворах сильного электролита, имеющего одноименный со слабым электролитом ион. Например, в аммонийном буферном растворе находятся слабое основание NH4OH и сильный электролит NH4Cl. Катион обоих электролитов одинаков.
2. рН буферных растворов практически не изменяется при добавлении к ним небольших количеств сильных кислот или щелочей. Это обусловлено тем, что буферные растворы являются одновременно и кислотой, и основанием. Например, в ацетатном буферном растворе CH3COOH выполняет функцию кислоты и в случае уменьшения концентрации ионов водорода в растворе поставляет их за счет диссоциации, а CH3COONa выполняет функцию основания и является акцептором ионов водорода при увеличении их концентрации в растворе.
3. Величина рН буферного раствора рассчитывается по формулам:
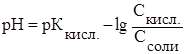 и
и 
Пример 7. Определите рН аммонийного буферного раствора, если известен состав данного буфера: 0,1М NH4OH и 0,1М NH4Cl. Как изменится рН: а) если к 1 л буферного раствора добавить 0,01 моль гидроксида натрия; б) если разбавить буферный раствор в 10 раз?
Решение: Так как в состав буферного раствора входит основание, то вначале определим рОН буферного раствора по формуле:
 (1),
(1),
где 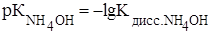 . Из таблицы III Приложения находим, что
. Из таблицы III Приложения находим, что 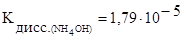 следовательно,
следовательно,
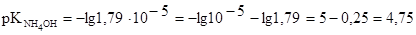
Подставляем все числовые значения в формулу (1) и находим
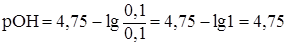
Зная, что рОН + рН = 14, находим значение рН буферного раствора:
pH = 14 - 4,75= 9,25
а) к 1 л буферного раствора добавили 0,01 моль NaOH, при этом гидроксид натрия будет реагировать с солью:
NaOH + NH4Cl = NH4OH + NaCl и изменятся концентрации и основания, и соли в буферном растворе.
По уравнению реакции:
из 1 моль NaOH образуется 1 моль NH4OH, следовательно, из 0,01 моль NaОН образуется 0,01 моль NH4OH. Концентрация NH4OH увеличится на 0,01 моль и станет равной: 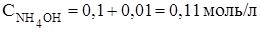
Концентрация NH4Cl уменьшится на 0,01 моль и станет равной:
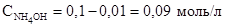 :
:
таким образом, 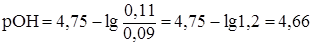 , рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
, рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
б) при разбавлении данного буферного раствора в 10 раз концентрации NH4OH и NH4Cl тоже уменьшаются в 10 раз, следовательно
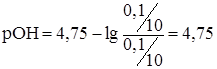
рН = 14-4,75=9,25 – рН буферного раствора не изменяется.
 2015-01-30
2015-01-30 3805
3805
