Кафедра безопасности жизнедеятельности и промышленной экологии
по дисциплине «Химия»
для студентов технических специальностей
Рудный 2012
ББК 24.6
Автор: Барулина И.В., Лабораторный практикум по дисциплине «Химия». – Рудный, РИИ, 2014– 72 с.
Рецензенты: Куликова Г.Г., заведующая кафедрой, к.х.н.
Олейник А.И., д.т.н., профессор
Рекомендовано к изданию УМС РИИ
Методические указания составлены в соответствии с требованиями учебного плана и программой дисциплины «Химия» и включает все необходимые сведения по выполнению тем лабораторных занятий курса.
Методические указания предназначены для студентов технических специальностей.
Табл. 9, Список лит. 7 назв.
Для внутрикафедрального использования
© Рудненский индустриальный институт
СОДЕРЖАНИЕ
Введение…………………………………………………………………….….….. 4
1 Лабораторная работа №1. Классы неорганических соединений ………………5
2 Лабораторная работа № 2. Окислительно-восстановительные реакции………8
3 Лабораторная работа №3. Комплексные соединения…………………………11
4 Лабораторная работа №4. Определение теплоты гидратации сульфата
меди(II)…………..….………………………………………………………….......14
5 Лабораторная работа №5. Скорость химических реакций……………..……..16
6 Лабораторная работа № 6. Химические равновесие. Смещение химического равновесия …………………………………………………………………….........20
7 Лабораторная работа №7. Приготовление растворов….……………...……….23
8 Лабораторная работа №8. Растворы электролитов ……………………………25
9 Лабораторная работа №9. Коллоидные растворы…..…………………………28
10 Лабораторная работа № 10. Водородный показатель и гидролиз солей……………….…..….……………………………………………………..….31
11 Лабораторная работа № 11. Общие свойства металлов и их соединений…..34
12 Лабораторная работа № 12. Железо, кобальт, никель…………..…….……...37
13 Лабораторная работа № 13. Электролиз растворов. Гальванические элементы……………………………………………………………………………40
14 Лабораторная работа №14. Коррозия металлов……………….…..…….. …43
15 Лабораторная работа №15. Качественное определение состава органических соединений………………………………………………………………………....46
16 Лабораторная работа № 16. Качественное определение ионов в растворах…..49
17 Лабораторная работа № 17. Титрование по методу нейтрализации……….........56
18 Лабораторная работа № 18. Определение жесткости воды…………….…….....59
19 Лабораторная работа №19.Свойства полимерных материалов ……………62
Список литературы…………………………………………..……………………..65
Приложение А - Форма оформления титульного листа..……………......……..66
Приложение Б - Форма оформления лабораторной работы ………..…………67
Приложение В - Пример оформления работы по качественному анализу…......68
ВВЕДЕНИЕ
Приобретение определенного комплекса знаний по химии, необходимого для успешного изучения последующих дисциплин, невозможно без лабораторного эксперимента, осмысления и обобщения наблюдаемых явлений и полученных экспериментальных фактов.
Опыт показывает, что любой сложный материал легче воспринимается на лабораторных занятиях, где каждый студент приобретает умения и навыки расчетов, решения экспериментальных задач.
Целью методических указаний к лабораторному практикуму по дисциплине «Химия» является оказание студентам помощи в подготовке к лабораторным работам и приобретению практических навыков проведения экспериментальных опытов и обработке результатов эксперимента.
Каждая лабораторная работа включает в себя общие сведения по теме занятия, методику проведения опытов, контрольные вопросы.
Студент самостоятельно должен подготовиться к выполнению лабораторной работы. Для этого необходимо изучить теоретические вопросы по предлагаемой литературе и лабораторному практикуму, уяснить цель и задачи каждого опыта, а также письменно составить план проведения опытов. Работа оформляется на двойных тетрадных листах в клетку или формате А4 и вкладывается в файл. На первой странице указываются тема работы, фамилия и имя студента, группа, фамилия и инициалы преподавателя, ведущего занятия согласно приложению А. Отчет по лабораторной работе оформляется по образцу, приведенному в приложении Б. При подготовке к лабораторной работе необходимо заполнить графы: 1,2,3,5. Графы 4,6 заполняются во время проведения опытов непосредственно при выполнении лабораторной работы. Графа 7 заполняется преподавателем при проверке лабораторной работы. Графики по результатам опытов строятся на миллиметровой бумаге и вклеиваются в отчет. Выводы по работе должны быть лаконичными и правильными. Работа по качественному анализу катионов и анионов оформляется согласно образцу, приведенному в приложении В.
Перед началом лабораторной работы преподаватель контролирует подготовку студента к выполнению работы: проверяет составленный план, проводит собеседование или тестирование по работе. Студенты, не готовые к проведению лабораторных опытов, к работе не допускаются.
После выполнения всех опытов и оформления работа сдается на проверку преподавателю в день проведения лабораторной работы. По каждой лабораторной работе проводится защита, которая осуществляется на занятиях по СРСП. В защиту включены основные вопросы по теме лабораторной работы. Отдельно выставляется балл за подготовку, выполнение и защиту каждой лабораторной работы. Количество баллов, проставляемое за каждый вид деятельности, утверждается в начале семестра на заседании кафедры и доводится до сведения студента.
1 ЛАБОРАТОРНАЯ РАБОТА № 1. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель: Экспериментально изучить свойства основных классов неорганических соединений.
Теоретическая часть
Неорганические соединения делятся на несколько классов: оксиды, кислоты, основания, соли.
Оксиды - это сложные вещества, молекулы которых состоят из атомов двух элементов, причем одним из них является кислород. Оксиды образуются при горении простых веществ в кислороде или на воздухе и разложении сложных веществ. Различают оксиды основные, кислотные и амфотерные.
Основными оксидами называются оксиды, которые, соединяясь с водой, дают основания, а, реагируя с кислотами, образуют соль и воду:
Na2O + H2O = 2NaOH
CuO + H2SO4 = CuSO4 + H2O
К основным оксидам относятся оксиды металлов.
Кислотными оксидами являются такие оксиды, которые, реагируя с водой, дают кислоты, а, реагируя с основаниями, образуют соль и воду:
SO3 + H2O = H2SO4
Ca(OH)2 + CO2 = CaCO3 + H2O
К кислотным оксидам относятся оксиды неметаллов.
Амфотерными оксидами являются оксиды, проявляющие основные и кислотные свойства:
ZnO + 2NaOH = Na2ZnO2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
Кислоты - это сложные вещества, молекулы которых содержат атомы водорода, способные замещаться или обмениваться на атом металла: HCl – соляная кислота, H2SO4 - серная кислота, Н3РО4 – ортофосфорная.
Для кислот характерны реакции взаимодействия с металлами, основными оксидами, растворимыми и нерастворимыми основаниями и солями:
Zn + 2HCl = ZnCl2 + H2
NaOH + HNO3 = NaNO3 + H2O
По силе кислоты делятся на сильные и слабые, сильные - азотная, соляная, серная кислоты, слабые - уксусная, угольная. Основностью кислоты называется число атомов водорода в молекуле кислоты, способных замещаться на металл с образованием соли: HCl – одноосновная, H2SO4 – двухосновная, H3PO4 – трехосновная кислоты. По наличию кислорода в своем составе кислоты делятся на кислородсодержащие HNO3, H2SO4 и бескислородные: HCl, H2S.
Основаниясостоят из металла и одновалентных групп – ОН, число которых равно валентности металла. Важнейшее химическое свойство оснований - способность образовывать соли с кислотами:
NaOH + HCl = NaCl + H2O
По растворимости основания делятся на растворимые, щелочи: NaOH, KOH и нерастворимые: Cu(OH)2, Fe(OH)3. По силе основания делятся на сильные и слабые. Сильные основания – все щелочи. В случае металлов с переменной валентностью в скобках указывается валентность металла в данном основании. Так Fe(OH)3 - гидроксид железа(III).
Соли – это продукт замещения водорода в кислоте на металл или гидроксильных групп в основании на кислотный остаток. При полном замещении гидроксильных групп на кислотный остаток получаются средние (нормальные) соли, при неполном – или кислые, или основные. Кислая соль получается при неполном замещении водорода кислоты на металл, основная соль получается при неполном замещении гидроксильных групп основания на кислотный остаток. Очевидно, что кислая соль может быть образована только кислотой, основность которой равна двум или больше, а основная соль – металлом, валентность которого равна двум или больше:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CaSO4 – нормальная соль (сульфат кальция)
КОН + H2SO4 = КНSO4 + H2O
КНSO4 – кислая соль (гидросульфат калия)
MgCl2 + KOH = MgOHCl + H2O
MgOHCl –основная соль (гидроксохлорид магния).
Соли, образованные двумя металлами и одной кислотой, называются двойными солями – KAl(SO4)2 – алюмокалиевые квасцы или сульфат калия-алюминия.
Соли, образованные одним металлом и двумя кислотами называются смешанными солями – СаОСl2 – кальциевая соль соляной НСl и хлорноватистой НСlО кислот.
Опыт 1. Получение оксида меди (II).
В пробирку налейте 1-2 мл раствора CuSO4 и добавьте раствор щелочи до выпадения осадка. Затем пробирку нагрейте. Наблюдайте изменение цвета осадка вследствие образования оксида меди (II). Напишите уравнения реакций образования гидроксида меди (II) и его разложения.
Опыт 2. Получение солей.
А) Обменное взаимодействие солей.
К раствору хлорида бария добавьте раствор сульфата натрия. Что наблюдается? Напишите молекулярное и ионное уравнения реакций.
Налейте в пробирку немного щелочи и добавьте к ней 1-2 капли раствора фенолфталеина. Приливайте к окрашенному раствору раствор фосфорной кислоты до исчезновения окраски. Почему исчезла окраска? Напишите молекулярное и ионное уравнения реакций.
Опыт 3. Получение и изучение свойств амфотерного гидроксида.
В пробирку с раствором Al2(SO4)3 добавьте медленно по каплям раствор щелочи до образования осадка гидроксида алюминия. Полученный осадок разлейте в две пробирки. В одну пробирку налейте раствор азотной кислоты, а в другую – щелочь до полного растворения осадка. Напишите уравнения реакций образования гидроксида алюминия, взаимодействия его с кислотой и щелочью. Какие вещества образовались? К каким классам химических соединений они относятся?
Контрольные вопросы
1) Какие вещества относятся к оксидам, гидроксидам, кислотам и солям?
2) В чем принципиальное отличие взаимодействия соляной и азотной кислот с металлами?
3) Что такое амфотерные соединения, и какими свойствами они обладают?
4) Как можно получить кислые и основные соли? Приведите уравнения реакций.
5) Приведите не менее восьми способов получения средних солей.
6) Приведите не менее четырех способов получения оксидов.
7) Составьте схему, показывающую генетическую связь между различными классами неорганических соединений.
2 ЛАБОРАТОРНАЯ РАБОТА № 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель: Изучить методику выполнения окислительно-восстановительных реакций, установить зависимость окислительно-восстановительных свойств соединений от реакции среды, приобрести навыки составления уравнений окислительно-восстановительных реакций.
Теоретическая часть
Для характеристики состояния атома в молекуле введено понятие – «степень окисления». Степень окисления – это условный формальный заряд атома в молекуле, вычисленный исходя из предположения, что молекула нейтральна и состоит только из ионов. При этом следует помнить правило: - алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ, например реакция:
Са2+С4+О32‾=Са2+О2ˉ + С4+О22ˉ
Степень окисления каждого из атомов после реакции не изменилась. Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ. Например, реакция:

2Fe3+Cl3‾ + Sn2+Cl2‾ = 2 Fe2+Cl2‾ + Sn4+Cl4‾
олово и железо изменяют степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ за счет приема и отдачи электронов, называются окислительно-восстановительными реакциями.
Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается:
Al0 - 3ē→Al3+; Fe2+ - ē→Fe3+; 2Clˉ - 2ē→Cl 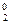
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается: О2 + 4 ē→ 2О2ˉ
Атомы, молекулы или ионы, называются восстановителями и во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями, во время реакции они восстанавливаются. Окисление всегда сопровождается восстановлением и наоборот. Таким образом, окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. Для составления уравнений окислительно-восстановительных реакций применяются два метода: метод электронного баланса и метод полу реакции.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Рассмотрим составление уравнения окислительно-восстановительной реакции методом электронного баланса:
1) Сначала пишем схему реакции, взятые и полученные вещества:
H2S + KMnO4 + H2SO4 → K2SO4 + MnSO4 + S + H2O
2) Определяем изменение степеней окисления атомов до и после реакции:
H2S2ˉ+ KMn7+ O4 + H2SO4 → K2SO4 + Mn2+SO4 + S0 + H2O
3) Составляем электронное уравнение приема и отдачи электронов ионами, изменяющими свои степени окисления:
S2ˉ - 2 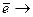 S0 восстановитель, процесс окисления
S0 восстановитель, процесс окисления
Mn7+ + 5 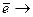 Mn2+ окислитель, процесс восстановления
Mn2+ окислитель, процесс восстановления
4) Находим коэффициенты при окислителе и восстановителе. Для этого находим наименьшее кратное для чисел 2 и 5 – это 10. Чтобы количество отданных электронов было равно количеству принятых, это наименьшее кратное делим на количество принятых и отданных электронов. В нашем примере:
5 | S2ˉ - 2 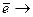 S0
S0
2 | Mn7+ + 5 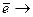 Mn2+
Mn2+
5) Подставляем эти коэффициенты в уравнение реакции:
5H2S + 2KМnO4 +H2SO4 → K2SO4 + 2MnSO4 + 5S +H2O
6) Затем уравниваем элементы, входящие в соединение с окислителем и восстановителем, уравниваем количество молекул кислоты и в последнюю очередь – атомов водорода. Правильность написания уравнения проверяем по количеству атомов кислорода в левой и правой частях равенства. Законченное уравнение имеет вид:
5H2S + 2KМnO4 +3H2SO4 = K2SO4 + 2MnSO4 + 5S + 8H2O
Влияние среды на характер реакции
Реакции окисления – восстановления могут протекать в различных средах; в кислой (избыток ионов H+), в нейтральной (Н2О), в щелочной (избыток ионов ОН-). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион MnO4ˉ (Mn7+) в кислой среде восстанавливается до Mn2+, в нейтральной – до MnO2 (Mn4+), а в щелочной – до MnO 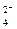 (Mn6+). Схематически это выглядит так:
(Mn6+). Схематически это выглядит так:
 |
| |||

 Н2О
Н2О
|
Опыт 1. Окисление сульфита натрия перманганатом калия в различных средах.
В три пробирки налейте по 1мл раствора перманганата калия КМпО4. В одну из этих пробирок добавить 1 мл серной кислоты, в другую 1мл дистиллированной воды, в третью 1 мл раствора щелочи. Затем в каждую пробирку добавьте несколько кристалликов сухого сульфита натрия. Наблюдайте изменение цвета раствора перманганата калия в трех пробирках. Напишите уравнения реакций и электронные уравнения и уравняйте, укажите окислитель и восстановитель. Сделайте вывод о влиянии среды на реакцию.
Опыт 2. Окисление ионов йода нитритом натрия.
Налейте в пробирку 1 мл раствора иодида калия, добавьте 1 мл фосфорной кислоты и затем добавьте несколько кристалликов нитрита натрия NaNO2 (Работать строго в вытяжном шкафу!). Наблюдайте появление осадка за счет образования свободного йода и выделение бурого газа (NO). Составьте уравнение реакции, электронные уравнения, уравняйте и укажите окислитель с восстановителем.
Опыт 3. Окисление нитрита натрия дихроматом калия.
В пробирку налейте раствор дихромата калия, добавьте такое же количество фосфорной кислоты. В эту же пробирку насыпьте немного нитрита натрия. Напишите уравнение реакции, электронные уравнения и уравняйте, укажите окислитель и восстановитель.
Контрольные вопросы
1) Какие реакции называются окислительно-восстановительными?
2) Какие вещества в реакциях являются окислителями, какие – восстановителями?
3) Охарактеризуйте типы окислительно-восстановительных процессов.
4) Какие вещества являются наиболее типичными окислителями или восстановителями?
5) Исходя из степени окисления хлора в соединениях НС1, НСlО3, НС1О4 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства.
6) Какой процесс — окисление или восстановление происходит при следующих превращениях: Мn6+ →Мn2+; С15+→С1ˉ; N3-→ N5+.
7) Напишите уравнения реакций восстановления перманганата калия в нейтральной, кислой и щелочной среде.
 2015-01-30
2015-01-30 1519
1519
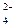 ) – зеленый р-р
) – зеленый р-р