Закон сохранения массы (М.В. Ломоносов, 1748 г.; А.Л. Лавуазье 1780 г.)
масса веществ, вступивших в химическое взаимодействие всегда равна массе образовавшихся веществ.
Закон является материальной основой для составления химических уравнений, подбора стехиометрических коэффициентов и расчетов по ним.
Закон кратных отношений (Дж. Дальтон, 1803 г.)
Если два элемента образуют друг с другом несколько химических соединений, то количество одного элемента, приходящееся на одно и тоже количество другого элемента, относятся между собой как небольшие целые числа
Для многих кристаллических соединений наблюдаются отклонения от кратных отношений закона.
Закон постоянства состава (Ж.Л. Пруст, 1808 г.).
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен. По предложению советского физика-химика Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Д. Дальтона), вторые - бертоллидами (в память французского химика К.Л. Бертолле, предвидевшего такие соединения). В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение. Состав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Закон эквивалентов - Вещества реагируют друг с другом в количествах, равных их эквивалентвм, nэ(А) = nэ(В).
Химический эквивалент – реальная или условная частица, соответствующая атомарному водороду или одному электрону в окислительно-восстановительной реакции.. Выражается в молях
ZnCl2. Двухвалентный цинк, Э = 1/2 молярной массы.
AlCl3. Трехвалентный алюминий, Э = 1/3 М.
Al2(SO4)3. Два трехвалентных алюминия, Э = 1/(2*3) = 1/6 М.
CrO3. Шестивалентный хром, Э = 1/6 молярной массы.
Число 1/2, 1/3, 1/6, т.е. число, показывающее, какая часть молекулы (молярной массы) соответствует одному эквиваленту, называются фактор эквивалентности, f.
Молярную массу эквивалента можно найти по формуле: Мэ = Mr*f,
где Mr - молярная масса вещества, но так же может быть атомная масса, масса иона и т.д.
Для водорода эквивалентная масса составит mэ = 2*(1/2) = 1 г-экв. f = 1/2, поскольку каждый атом водорода соответствует одной единице валентности (одному эквиваленту), а молекула водорода двухатомна.
Эквивалентный объем составит Vэ = Vм * f = 22,4*(1/2) = 11,2 л/моль-экв.
Для кислород а эквивалентная масса составит mэ = 32*(1/4) = 8 г-экв. f = 1/4, поскольку каждый атом кислорода соответствует двум единицам валентности (двум эквивалентам, кислород двухвалентен), а молекула кислорода двухатомна.
Эквивалентный объем составит Vэ = Vм * f = 22,4*(1/4) = 5,6 л/моль-экв.
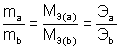 Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
,
где 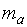 и
и 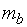 – массы веществ, г;
– массы веществ, г; 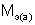 и
и 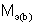 – молярные массы эквивалентов веществ, г/моль;
– молярные массы эквивалентов веществ, г/моль; 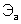 и
и 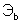 – эквиваленты веществ, моль.
– эквиваленты веществ, моль.
Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находится в газообразном состоянии, закон эквивалентов принимает вид:
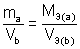 или
или 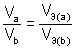 , где
, где 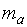 – масса твердого или жидкого вещества, г;
– масса твердого или жидкого вещества, г; 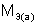 – молярная масса эквивалента твердого (жид к ого) вещества, г/моль;
– молярная масса эквивалента твердого (жид к ого) вещества, г/моль; 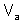 ,
, 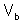 – объем газообразного вещества (н.у.), л;
– объем газообразного вещества (н.у.), л; 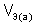 ,
, 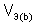 – молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
– молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
Молярный объем эквивалента вещества 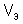 – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
– это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то молярный объем эквивалента газообразного водорода будет равняться 11,2 л/моль, а кислорода – 5,6 л/моль.
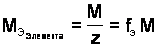 Молярная масса эквивалентов элемента в соединении не является величиной постоянной. Она зависит от валентности элемента в данном соединении и выражается,
Молярная масса эквивалентов элемента в соединении не является величиной постоянной. Она зависит от валентности элемента в данном соединении и выражается,  , уравнением:
, уравнением:
,
Эквивалентная масса равна отношению молярной массы элемента к его окислительному числу.
2. Атом - является наименьшей частицей элемента, сохраняющей его характеристики.
Каждый атом имеет ядро,расположенное в центре атома. Оно содержит положительно заряженные частицы – протоны и незаряженные частицы – нейтроны. Электроны, отрицательно заряженные частицы, вращаются вокруг ядер. Количество протонов в ядре атома называется атомным номером элемента.
Молекула – нейтральная электрически частица, которая состоит из двух и более атомов, связанных ковалентными связями; наименьшая частица вещества, которая обладает его свойствами.
Молекула состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул данного вещества не зависят от способа его получения. В случае одноатомных молекул (например, инертных газов) понятия молекулы и атома совпадают.
Свободные радикалы — частицы (как правило, неустойчивые), содержащие один или несколько неспаренных электронов.
Свободный радикал - вид молекулы или атома, способный к независимому существованию (т.е. обладающий относительной стабильностью) и имеющий один или два неспаренных электрона.
Неспаренный электрон занимает атомную или молекулярную орбиталь в одиночку. Как правило, радикалы обладают парамагнитными свойствами, так как наличие неспаренных электронов вызывает притяжение к магнитному полю. Кроме этого наличие неспаренного электрона способно значительно усилить реакционную способность, хотя это свойство радикалов широко варьирует.
Хими́ческий элеме́нт совокупность атомов, имеющих одинаковые заряды ядра.
Планетарная модель атома, или модель Резерфорда — историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеиванию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов.
Квантовые постулаты Н. Бора
Для объяснения устойчивости атомов Нильс Бор предложил отказаться от привычных классических представлений и законов при объяснении свойств атомов. Основные свойства атомов получают последовательное качественное объяснение на основе принятия квантовых постулатов Н. Бора.
1. Электрон, вращаясь вокруг ядра по определенным (дискретным) орбитам не излучает и не поглощает энергию.
2. Атом излучает и поглощает энергию, переходя с одной орбиты на другую.
Стационарное состояние атома с минимальным запасом энергии называется основным состоянием, все остальные состояния называются возбуждёнными (квантовыми) состояниями. В основном состоянии атом может находиться бесконечно долго, время жизни атома в возбуждённом состоянии длится
10-9-10-7 секунды.
3. Излучение или поглощение энергии происходит только при переходе атома из одного стационарного состояния в другое.
Энергия кванта электромагнитного излучения при переходе из стационарного состояния с энергией Еm в состояние с энергией Еn равна разности энергий атома в двух квантовых состояниях:
∆Е = Еm – Еn = hv, где v – частота излучения, h = 2ph = 6,62 ∙ 10-34 Дж ∙с. Квантовая модель строения атома
Позже теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основу квантово-механичекой модели положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Де Бройль предложил уравнение связывающее волновые и корпускулярные свойства электронов.
Именно Борн правильно (насколько нам известно) отождествил 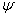 в уравнении Шредингера с амплитудой вероятности, предположив, что квадрат амплитуды – это не плотность заряда, а всего лишь вероятность (на единицу объема) обнаружить там электрон и что если вы находите электрон в некотором месте, то там окажется и весь его заряд. Вся эта идея принадлежит Борну.
в уравнении Шредингера с амплитудой вероятности, предположив, что квадрат амплитуды – это не плотность заряда, а всего лишь вероятность (на единицу объема) обнаружить там электрон и что если вы находите электрон в некотором месте, то там окажется и весь его заряд. Вся эта идея принадлежит Борну.
В квантовой механике принцип неопределённости Гейзенбе́рга устанавливает, что невозможно одновременно и сколько угодно точно измерить координаты и импульс движения микрочастицы, а так же энергию в тот или иной момент времени.
При этом результаты измерений будут случайными величинами, среднеквадратические отклонения которых от средних значений будут удовлетворять соотношению неопределённостей 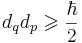 , где
, где 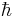 – постоянная Дирака. Считается, что принцип неопределённости связан не только с возможностями экспериментальной техники, но и показывает фундаментальное свойство природы.
– постоянная Дирака. Считается, что принцип неопределённости связан не только с возможностями экспериментальной техники, но и показывает фундаментальное свойство природы.
уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве (в общем случае, в конфигурационном пространстве) и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Установлено Эрвином Шрёдингером в 1926 году.
Зависимое от времени уравнение (общий случай) 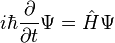 |
Наиболее общая форма уравнения Шрёдингера — это форма, включающая зависимость от времени.
 2015-01-30
2015-01-30 6236
6236








