| sp | 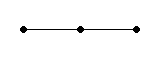 180° линейная 180° линейная | H–Be–H, HC≡CH |
| sp2 | 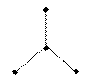 1200 плоская тригональная 1200 плоская тригональная | 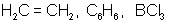 |
| sp3 | 109°28 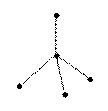 тетраэдрическая тетраэдрическая | 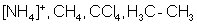 |
| sp2d | 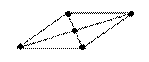 90° квадратная 90° квадратная | 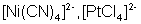 |
| sp3d или d sp3 | 90°, 120° 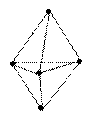 триагонально-бипирамидальная триагонально-бипирамидальная | 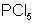 |
| d2sp3 или sp3d2 | 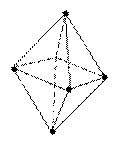 90° октаэдрическая 90° октаэдрическая |  |
Полярность – если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной (см. рис. 7, а), если электронная плотность смещена в сторону электроотрицательного атома, то ковалентная связь называется полярной (см. рис. 7, б).
Полярность связи тем больше, чем больше разность электроотрицательностей атомов, молекула называется диполем.
Поляризуемость – способность молекулы становиться полярной. Данное явление происходит под действием внешнего электрического поля или под влиянием другой молекулы, являющейся партнером по реакции.
Существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше полярность связи, тем меньше остается возможности для их дальнейшего смещения под действием внешних сил.
● Метод молекулярных орбиталей
Данный метод исходит из предположения, что состояние электронов в молекуле может быть описано как совокупность молекулярных электронных орбиталей, причем каждой молекулярной орбитали соответствует определенный набор молекулярных квантовых чисел.
 Основные положения метода МО:
Основные положения метода МО:
1. Молекулярная орбиталь (МО) является аналогам атомной орбитали (АО): подобно тому, как электроны в атомах располагаются на АО, общие электроны в молекуле располагаются на МО.
2. Для образования МО атомные орбитали должны обладать приблизительно одинаковой энергией и симметрией относительно напрвления взаимодействия.
3. Число МО равно общему числу АО, из которых комбинируются МО.
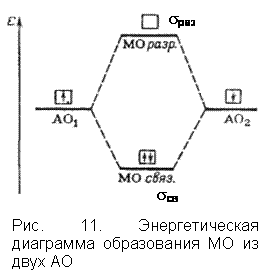
4. Если энергия МО оказывается ниже энергии исходных АО, то такие МО – связывающие, а если выше энергии исходных АО, то – разрыхляющие МО (рис. 11).
5. Электроны заполняют МО, как и АО в порядке возрастания энергии, при этом соблюдается принцип Паули и правило Гунда.
6. МО двухатомных молекул первого периода и второго (до N2) располагают в ряд: σ1s < σ* 1s < σ2s < σ* 2s < π2рy = π2рz < σ2px <π*2рy = = π*2рz < σ*2px.
МО двухатомных молекул конца второго периода по возрастанию энергии располагают: σ1s < σ* 1s < σ2s < σ* 2s<σ2px < π2рy = π2рz <π*2рy = π*2рz < σ*2px
7. В методе МО вместо кратности связи вводится понятие порядок связи n – полу разность числа связывающих и числа разрыхляющих электронов:
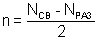 .
.
Порядок связи может быть равен нулю, целому или дробному положительному числу. При n = 0 молекула не образуется
8. Если на МО имеются неспаренные электроны, молекула парамагнитна, т. е. обладает магнитными свойствами; если все электроны спарены – диамагнитна,т. е. не обладает магнитными свойствами
ММО по сравнению с МВС позволяет получить реальные представления о химической связи и свойствах различных частиц (молекулы, ионы).
Электронные конфигурации молекул
Например: образование химической связи двухатомной молекулы водорода представлено через электронную формулу: 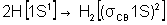 .
.
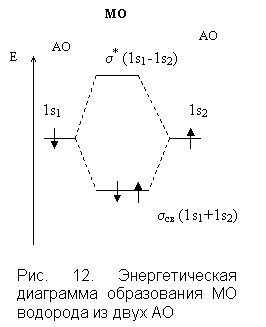 | Как видно (рис. 12), из двух s-орбиталей образуются две МО: одна связывающих и одна разрыхляющих. При этом МО принадлежат к σ-типу: они образованы взаимодействием s-орбиталей. Порядок связи: 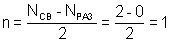 Характеризуя ММО и МВС, необходимо заметить, что оба квантовомеханических подхода к описанию химической связи – приближенны. ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях. МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами. Сравнивая МВС и ММО, следует отметить, что достоинством первого является его наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар. Характеризуя ММО и МВС, необходимо заметить, что оба квантовомеханических подхода к описанию химической связи – приближенны. ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях. МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами. Сравнивая МВС и ММО, следует отметить, что достоинством первого является его наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар. |
Однако существование некоторых соединений невозможно объяснить с позиций МВС. Это электронодефицитные соединения ( 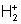 ) и соединения благородных газов. Их строение легко объясняет ММО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции ММО. И, наконец, магнетизм и окраска вещества также легко объясняются ММО.
) и соединения благородных газов. Их строение легко объясняет ММО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции ММО. И, наконец, магнетизм и окраска вещества также легко объясняются ММО.
 Количественные расчеты в ММО, несмотря на свою громоздкость, все же гораздо проще, чем в МВС. Поэтому в настоящее время в квантовой химии МВС почти не применяется. В то же время качественно выводы МВС гораздо нагляднее и шире используются экспериментаторами, чем ММО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
Количественные расчеты в ММО, несмотря на свою громоздкость, все же гораздо проще, чем в МВС. Поэтому в настоящее время в квантовой химии МВС почти не применяется. В то же время качественно выводы МВС гораздо нагляднее и шире используются экспериментаторами, чем ММО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
 2015-01-30
2015-01-30 1444
1444
