Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кромеалмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Нитрид бора активированный углеродом является люминофором со свечением в УФ от синего до жёлтого цвета и обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но являлся широкой любительской практикой в первой половине XX века.
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Простейший гидрид бора - BH3 - не существует, поскольку атом бора в данной молекуле должен содержать на внешнем уровне шесть электронов вместо восьми (завершенные электронный уровень). Электронодефицитность бора компенсируется за счет образования мостиковых связей с атомом водорода.
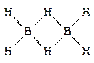
В молекулах других бороводородов наряду с мостиковыми и терминальными (концевыми) связями бор - водород образуются связи бор - бор, что приводит к образованию более сложных структур.
Обычным методом получения бороводородов (боранов) является гидролиз боридов металлов, например:
6MgB2 + 12HCl = B4H10 + 8B + 6MgCl2 + H2
Бороводороды - высокореакционноспособные вещества, на воздухе горят, многие самовоспламеняются, разлагаются водой:
B2H6 + 3O2 = B2O3 + 3H2O
B2H6 + 6H2O = 2H3BO3 + 6H2
Бороводороды и органические соединения бора широко применяются в качестве ракетного топлива.
Оксид бора - B2O3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием борной кислоты:
B2O3 + 3H2O = 2H3BO3
Получается борная кислота также при действии сильных кислот на тетрабораты:
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
H3BO3 - очень слабая кислота, причем ее кислотность проявляется не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H3BO3 + H2O  H+ + [B(OH)4]-
H+ + [B(OH)4]-
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора.
Нитрид бора получается прямым взаимодействием простых веществ и существует в двух модификациях: графито- и алмазоподобной (эльбор), имеющей кубическую кристаллическую решетку. Эльбор - очень твердый материал, некоторые его образцы царапают алмаз. При этом он термически устойчив до 2000 °С.
 2015-01-30
2015-01-30 6720
6720
