Кре́мний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si (лат. Silicium), неметалл. Простое вещество кремний имеет номер CAS 7440-21-3.
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния(IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
«Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
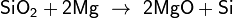
При этом образуется бурый порошок аморфного кремния».
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
|
|
|
Возможна дальнейшая очистка кремния от примесей.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствиикислорода, воздуха или воды (водяных паров).
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4 и, возможно, галогенидов более сложного состава.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем.
Нижележащие элементы 4-й группы (Ge, Sn, Pb) неограниченно растворимы в кремнии, как и большинство других металлов. При нагревании кремния с металлами могут образовываться силициды.
При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO. Этот процесс постоянно наблюдается при производстве кристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются контейнеры из диоксида кремния, как наименее загрязняющего кремний материала.
|
|
|
Диоксид кремния в нормальных условиях всегда является твёрдым биоинертным, неразлагаемым веществом, склонным к образованию пыли, состоящей из частиц с острыми режущими кромками. Вредное действие диоксида кремния и большинства силицидов и силикатов основано на раздражающем и фиброгенном действии, на накоплении вещества в ткани лёгких, вызывающем тяжёлую болезнь — силикоз.
Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты общей формулы nSiO2•mH2O.
Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O. Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
Все поликремниевые кислоты малорастворимы в воде. В воде образуют коллоидные растворы по общей схеме реакции:
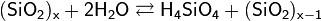
Образовавшаяся неустойчивая ортокремниевая кислота вступает в реакции поликонденсации:
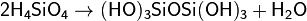
в результате чего образуются сложные линейные, разветвлённые и смешанные структуры.
Кремниевые кислоты являются слабыми. Для метакремниевой кислоты H2SiO3 константы диссоциации K1 = (2-3)•10-10, K2 ~ 10-11÷-13, для ортокремниевой H4SiO4 K1 = 2•10-10, K2 = K3 = K4 = 2•10-12.
Кремниевые кислоты растворяются в растворах и расплавах щелочей, образуя силикаты:
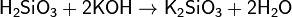
Растворы кремниевых кислот получают растворением аморфного диоксида кремния в воде, действием сильных кислот на растворимые силикаты натрия или калия:
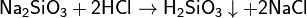
гидролизом хлорсиланов:
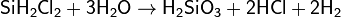
а также методами электродиализа и ионного обмена.
 2015-01-30
2015-01-30 7605
7605
