К элементам главной подгруппы IV группы относятся углерод, кремний, германий, олово, свинец. Металлические свойства усиливаются, неметаллические - уменьшаются. На внешнем слое – 4 электрона.
Химические свойства (на основе углерода)
- Взаимодействуют с металлами:
4Al + 3C = Al4C3 (реакция идсет при высокой температуре)
- Взаимодействуют с неметаллами:
2Н2 + C = CН4
2S + C = CS2
- Взаимодействуют с кислородом:
C + O2 = CO2
2C + O2 = 2CO
- Взаимодействуют с водой:
C + H2O = CO + H2
- Взаимодействуют с оксидами:
2Fe2O3 + 3C = 3CO2 + 4Fe
- Взаимодействуют с кислотами:
3C + 4HNO3 = 3CO2 + 4NO + 2H2O
Углерод. Характеристика углерода, исходя из его положения в периодической системе, аллотропия углерода, адсорбция, распространение в природе, получение, свойства. Важнейшие соединения углерода
Углерод (химический символ — C, лат. Carboneum) — химический элемент четырнадцатой группы (по устаревшей классификации — главной подгруппы четвёртой группы), 2-го периода периодической системы химических элементов. порядковый номер 6, атомная масса — 12,0107.
|
|
|
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½ = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры.
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. Жидкий углерод существует только при определенном внешнем давлении.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15-20 % выше плотности алмаза), имеющей металлическую проводимость.
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
|
|
|
Графен (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку.
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300-500 °C, 600-700 °C и 850-1000 °C.
Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан.
При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
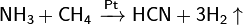
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2.
С большинством металлов углерод образует карбиды, например:
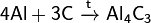
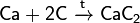
Важна в промышленности реакция углерода с водяным паром:
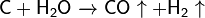
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы,полимеры и другие соединения. Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100-400 мкг/м³, крупными городами 2,4-15,9 мкг/м³, сельскими районами 0,5-0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6-15) · 109 Бк/сут 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Важнейшие соединения. Оксид углерода (II) (угарный газ) CO. В обычных условиях - бесцветный без запаха и вкуса очень ядовитый газ. Ядовитость объясняется тем, что она легко соединяется с гемоглобином крови.
|
|
|
Оксид углерода (IV) CO2. При обычных условиях - бесцветный газ со слегка кисловатым запахом и вкусом, в полтора раза тяжелее воздуха, не горит и не поддерживает горения.
Угольная кислота H2CO3. Слабая кислота. Молекулы угольной кислоты существуют только в растворе.
Фосген COCl2. Бесцветный газ с характерным запахом, tкип = 8оС, tпл = -118оС. Очень ядовит. Мало растворим в воде. Реакционноспособен. Используется в органических синтезах.
 2015-01-30
2015-01-30 25384
25384








