| Разложение при прокаливании | CaCO3=CaO+CO2 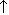
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl 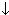 +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2 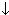 +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 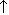
|
14. Взаимодействие атомов. Причины образования химической связи. Природа химической связи. Типы химической связи (ковалентная, ионная, водородная, металлическая). Характеристики химической связи – энергия, длина, полярность. Силы Ван-дер-Ваальса.
Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
Различают три основных типа химической связи: ковалентную, ионную, металлическую.
Таблица.Типы химической связи и их основные отличительные признаки.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электрополо- жительный и электро- отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобраз- ный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрица- тельный реже электрополо- жительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | ||||
| Металличес кая | Атомы металлов | Электрополо- жительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металличес- кая | Металлы и сплавы |
 2015-01-30
2015-01-30 534
534








