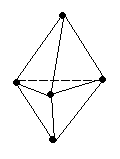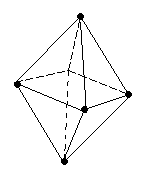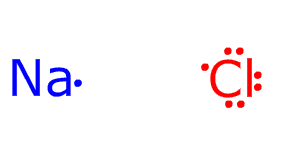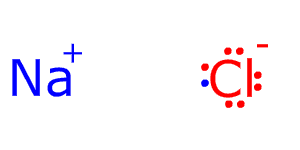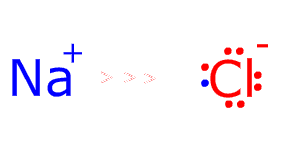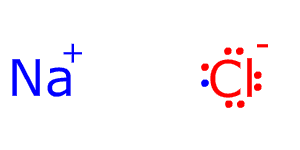
Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
Металлы и их сплавы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической решётки ионы, более или менее свободно перемещаются в пространстве между катионами и обуславливают электрическую проводимость металлов. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной возникновения металлической связи.
Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной (происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах.
СПЛАВЫ.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы(углерод, сера, кремний). Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако некоторые металлы не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твёрдые растворы внедрения (часть межузельных полостей решётки занята атомами другого элемента, например атомы углерода в железе-чугун и стали); твёрдые растворы замещения (часть атомов основного вещества заменена на атомы примесного элемента-оловянный припой-64 части олова и 36-свинца); смеси индивидуальных кристаллов металлов; смеси кристаллов интерметалических соединений (сплавляемые металлы образуют химические соединения-в бронзе присутствует соединение Cu3Sn)
Ван-дер-Ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. ОткрытыЯ. Д. ван дер Ваальсом в 1869 году.
Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкостьи твёрдые тела).
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия, а также водородные связи, определяют формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами
15. Метод валентных связей. Представление о гибридизации атомных орбиталей. Геометрия многоатомных молекул: модель Гиллеспи.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2 s 11 p 1), B*(2 s 12 p 2), C*(2 s 12 p 3) образуют за счет s - и p -орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s - и p -АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s - и p -орбитали дают две sp -ГО, расположенные под углом 180° друг относительно друга.
| sp | 180°
| H–Be–H, HC≡CH | ||
| sp 2 | 120°
| H2C=CH2, C6H6, BCl3 | ||
| sp 3 | 109°28'
| [NH4]+, CH4, CCl4, H3C–CH3 | ||
| sp 2 d | 90°
| [Ni(CN)4]2–, [PtCl4]2– | ||
| sp 3 d или dsp 3 | 90°, 120°
| PCl5 | ||
| d 2 sp 3 или sp 3 d 2 | 90°
| [Fe(CN)6]3–, [CoF6]3–, SF6 |
Гибридные орбитали и геометрия молекул
Модель Гиллеспи основывается на предположении о том, что связь осуществляется за счет пары электронов, а геометрическое строение молекул/ионов определяется общим числом электронных пар, окружающих центральный атом. При этом выполняются следующие правила:
· Электронные пары, поделенные и неподеленные, располагаются вокруг центрального атома так, чтобы их отталкивание было минимальным, т.е. на максимально удаленном расстоянии друг от друга
· Неподеленная электронная пара занимает больший объем, чем поделенная
· Объем занимаемой связующей электронной пары тем меньше, чем ьольше электроотрицательность атома, связанного с центральным
· Две электронные пары с двойной связью занимают больший объем, чем одна пара одинарной связи
Недостатки модели Гиллеспи
· Неприменимость к большинству соединений d-, s-элементов
· Неприменимость к соединениям с существенной доли ионности связи
· Невозможность предсказать геометрию молекул/ионов с инертной неподеленной электронной парой
16. Метод молекулярных орбиталей. Основные понятия. Двухцентровые двухэлектронные молекулярные орбитали. Энергетические диаграммы двухатомных гомоядерных молекул, образованных элементами 1-го и 2-го периодов. Магнитные свойства. Корреляции между порядком связи и энергией ионизации. Энергетические диаграммы простейших гетероядерных молекул (CO, HF, LiH, H2O).
В методе МО предполагают, что в молекуле, как и в атоме, можно построить набор разрешенных дискретных энергетических уровней и соответствующих им волновых функций (молекулярных орбиталей), описывающих поведение электрона в молекуле. На каждом энергетическом уровне может располагаться не более двух электронов. Для построения волновых функций МО часто используют атомные орбитали (АО), описывая каждую МО yi как линейную комбинацию АО (МО ЛКАО).
Выбор такого представления МО физически достаточно понятен: вблизи каждого ядра в молекуле поведение электрона должно быть похожим на его поведение в атоме и описываться соответствующими данному атому АО. При этом приближенное решение (так как для молекул уравнение Шредингера может быть решено только приближенно!) хотя бы в этих областях будет достаточно корректным. В области между ядрами МО будет описываться суперпозицией АО. Задача нахождения волновых функций МО при этом сводится к нахождению коэффициентов. Помимо этого, для каждой МО необходимо определить соответствующую ей энергию.
17. Молекула водорода и методы ее описания. Метод валентных связей и метод молекулярных орбиталей. Приближение ЛКАО. Перекрывание атомных орбиталей, сигма и пи связи, порядок (кратность) связи. Химическая связь в частицах H2, H2- и H2+ с позиции методов МО и ВС.
18. Химическая связь в гомоядерных двухатомных молекулах элементов второго периода с позиции методов МО и ВС. Схемы МО для молекул начала и конца второго периода. Изменение порядка связи, энергия связи, длины связи при переходе от Li2 к Ne2. Особенности молекул B2 и O2. Прочность связи в молекуле N2
19. Гетероядерные двухатомные молекулы элементов второго периода. Схемы МО для HF, CO, CN, OF. Метод ВС и гибридизации орбиталей. Валентное состояние атома. Типы гибридизаций и пространственное строение молекул по Гиллеспи.
20. Ковалентная связь в многоатомных молекулах. Донорно-акцепторное взаимодействие. Локализованная и делокализованная связь. Трехцентровые связи. Направленность и насыщаемость химической ковалентной связи. Теория отталкивания электронных пар валентной оболочки и пространственная структура молекул
Донорно-акцепторное взаимодействие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи (обменный механизм); или передача неподеленной электронной пары от донора к акцептору, приводящей к образованию связи (донорно-акцепторный механизм).
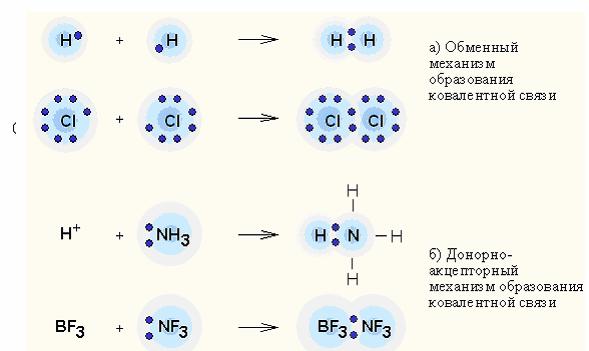 |
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) яд р ами атомов (подобие металлической связи).
| Ковалентная связь может быть локализованной и делокализованной. Локализованной называют связь, электроны которой фактически поделены между двумя ядрами связываемых атомов. Если электроны связи поделены более чем между двумя ядрами, то говорят о делокализованной связи. |
Делокализованная связь - это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов.
Делокализованные связи в большинстве случаев являются π-связями. Они характерны для сопряженных систем. В этих систе- мах осуществляется особый вид взаимного влияния атомов - сопряжение.
Сопряжение (мезомерия, от греч. mesos - средний) - это выравнивание связей и зарядов в реальной молекуле (частице) по сравнению с идеальной, но не существующей структурой.
Участвующие в сопряжении делокализованные р-орбитали могут принадлежать либо двум π-связям и более, либо π-связи и одному атому с р-орбиталью. В соответствии с этим различают π,π-сопряжение и ρ,π-сопряжение. Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы.
Двухэлектронная трёхцентровая связь — одна из возможных электроно-дефицитных связей. Характерна тем, что пара валентных электронов локализована в пространстве сразу трёх атомов (отсюда и понятие «электроно-дефицитности» — «нормальным» случаем является двухэлектронная двухцентровая связь). Общее описание механизма образования электронодефицитных связей даётся в рамках теории молекулярных орбиталей (модель «несвязывающих» орбиталей).
Наибольший вклад в развитие теории трёхцентровых двухэлектронных связей был сделан при изучении бороводородов и борорганических соединений, где подобное связывание реализуется очень часто (например, в диборане).
Возможны и другие электронодефицитные связи, с другим соотношением валентных электронов и связанных атомов. Подобное связывание часто реализуется в металлорганических соединениях.
Теория отталкивания электронных пар валентных орбиталей (ОЭПВО) — один из подходов в химии, необходимый для объяснения и предсказания геометриимолекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии).
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
21. Химическая связь и типы кристаллов. Типы кристаллических решеток. Основы зонной теории. Связь в металлах, полупроводниках и диэлектриках. Дефекты кристаллической решетки. Твердые растворы. Ионная связь. Взаимодействие ионов в кристаллической решетке. Энергия ионной кристаллической решетки, влияние размеров и зарядов ионов
Зонная теория – описание движения электронов в кристаллах, является основой современной теории металлов, полупроводников и диэлектриков.
Величина запрещенной зоны является ключевой величиной и определяет электрические и оптические свойства материала.
Проводники - материалы, из которых зона проводности и валентная зона перекрывания образуют одну зону – зону проводимости (т.о., электрон может свободно перемещаться между ними).
Диэлектрики – материалы, из которых зона не перекрывается. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется значительная энергия, поэтому диэлектрики почти не проводят ток.
Полупроводники – материалы, из которых зоны не перекрываются. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется энергия меньшая, чем для диэлектрика, поэтому чистые полупроводники слабо пропускают ток.
· Молекулярная - в узлах молекулярной решетки находится молекулы, это решетка присуща соединение с ковалентной связью, сюда относят не металлы,(исключения H,Si)?все органические соединения H2SO4?HCl
· Атомные – в узлах находятся атомы алмаз, графит – не растворяется в воде тугоплавки, вообще не растворимы
· Ионная – в узлах располагаются положительные,отрицательные ионы, которые связаны друг с другом ионами электрическим притяжением соли, основания, щелочи. Прочность, высокая температура плавления, не летучие, многие растворяются в воде
· Металлическая – в узлах расположены атомы металла, теплопроводны
 2015-01-30
2015-01-30 6549
6549