Энергия, которой обладает электрон в данном стационарном состоянии, схематически изображается в виде тонкой линии – уровня энергии. Рис.1.5
Для электрона в атоме водорода самым стабильным является первый (нормальный) уровень с наименьшим значением энергии.
Выше расположенные уровни - возбужденные.
Совокупность спектральных линий, которые возникают при переходе электрона на данный энергетический уровень с выше расположенных, называется спектральной серией. В спектре атома водорода известны семь спектральных серий. В видимой части спектра находится серия Бальмера, которая возникает при переходе электрона на второй энергетический уровень.
По второму постулату Бора 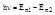
Подставляя En по формуле Бора, получим: 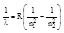 (обобщенная формула Бальмера), где
(обобщенная формула Бальмера), где
R - постоянная Ридберга; n1- номер уровня, на который переходит электрон; n2- значение уровня, с которого переходит электрон.
Для серии Бальмера n1=2.
Расчет 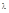 по этой формуле, полученной из теории Бора, совпал со значением
по этой формуле, полученной из теории Бора, совпал со значением 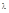 спектра водорода, полученным экспериментально.
спектра водорода, полученным экспериментально.
Применение теории Бора к многоэлектронным атомам потребовало введение дополнительных принципов.
Все это говорит о том, что теория Бора является переходным моментом от старой классической теории к новой квантовой теории.
 2015-01-30
2015-01-30 682
682








