АГРЕГАЦИЯ ПРИМЕСЕЙ ШАХТНЫХ ВОД
Коагуляция примесей воды
Цели и методы коагуляции шахтных вод
В процессе механической очистки из шахтных вод достаточно эффективно удаляются частицы размером более 10 мкм; тонкодисперсные и коллоидные частицы практически не удаляются. Это объясняется их седиментационной устойчивостью. Имея незначительные размеры и вес, они участвуют в броуновском движении, а следовательно способны диффундировать (не опускаться, например, а подниматься вверх). Способность к седиментации в таких частиц возникает только при их агрегации (укрупнении). В естественных условиях этому препятствует агрегативная устойчивость колоидно- и тонкодисперсных частиц, то есть способность сохранять свою дисперсность. Как известно, агрегативная устойчивость обусловлена расклинивающим давлением между частицами вследствие наличия оболочек (вокруг гидрофильных частиц, обычно органического происхождения) гидратов или двойного электрического слоя (вокруг гидрофобных частиц, обычно минерального происхождения). Для шахтных вод характерно преимущественное присутствие минеральных примесей, которые в диапазоне рН 6,5... 7,5 имеют отрицательный заряд.
Ликвидация или уменьшение электрического заряда частиц, разрушение их диффузной и гидратной оболочек приводит к нарушению агрегативной устойчивости и коагуляции примесей. Это достигается введением в обрабатываемую воду электролитов (электролитная коагуляция) или золей (коллоидов) с противоположным зарядом частиц (нейтрализационная коагуляция).
При обработке шахтных вод применяют как правило электролитную коагуляцию. В результате добавления в воду коагулянтов происходит постепенное снижение электрокинетического потенциала, иногда до нуля, но дальнейшее увеличение концентрации электролита в воде может вызвать перезарядку коллоидов с изменением заряда на противоположный. В этих условиях электрокинетический потенциал начинает расти и агрегативная устойчивость частиц увеличивается.
Коагуляция природных гидрофобных коллоидов, имеющих обычно ξ-потенциал в пределах 0,05... 0,1В, становится возможной при его снижении до 0,03В и менее.
Как коагулянты широко применяются сульфат и хлорид алюминия вместе с известью, а также соли железа. Коагуляция различными реагентами применима почти ко всем производственным сточным водам, включая шахтные.
Химизм процесса коагуляции
При введении коагулянта (соли многовалентных металлов) в воду он диссоциирует на ионы металла и анионы сильных кислот. Катионы металла с гидрокарбонат- и карбонат-ионами образуют малорастворимые гидроксиды:
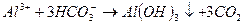
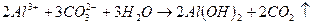
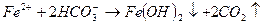
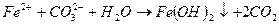
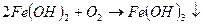
Кроме того, гидролиз избытка коагулянта, что заканчивается образованием коллоида металла (железа, алюминия и др.)
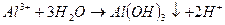
Накапливающиеся ионы водорода задерживают дальнейший ход реакции. Одновременно их концентрация снижает рН обрабатываемой среды, а следовательно увеличивает отличие этого показателя с рН изоэлектрического состояния вещества примеси (рНиз), т.е. усиливает агрегативную устойчивость примесей. Необходимо связывать в зоне реакции ионы водорода, образующиеся при гидролизе. Последнее достигается, во-первых, естественным образом при взаимодействии ионов водорода с анионами щелочности воды:
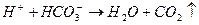
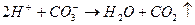
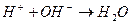
во-вторых (при дефиците щелочного резерва в обрабатываемой воде), путем добавления к воде (подщелачивание) извести или соды (при этом лучше подщелачивание проводить известью), в-третьих, удалением путем барботирования из зоны коагуляции (продувка воздухом) углекислого газа.
Интенсивность процессов осветления сточной воды может быть достигнута применением новых коагулянтов типа оксихлорида алюминия [Al2(OH)5] Cl6H2O и алюмината натрия NaAlO2, при коагуляции которых рН воды практически не изменяется, что имеет важное технологическое значение.
Различают два механизма коагуляции: объемная, происходящая в камерах хлопьеобразования и контактная коагуляция, которая может протекать в толще зернистой загрузки фильтра или в массе взвешенного осадка.
 2015-01-07
2015-01-07 3101
3101