Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства, в котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная теория, так и волновая теория, обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома. В учении о строении атома используются оба подхода, которые взаимно дополняют друг друга, В трактовке строения электронной оболочки атома и в объяснении механизма образования химической связи всегда нужно иметь в виду двойственный характер электрона, называемый корпускулярно-волновым дуализмом.
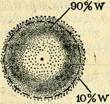
Обоснование орбитальной модели атома, исходящее из корпускулярного характера электрона, состоит в следующем. Вероятность определенного положения электрона внутри объема пространства, окружающего атомное ядро, весьма велика, так как рассматривается устойчивое (реально существующее) состояние атома. Если статистически описать меняющееся место пребывания единственного электрона атома водорода в зависимости от расстояния электрона от атомного ядра, то получается что вероятность пребывания электрона в атомном ядре равна нулю, она незначительна вблизи ядра, но быстро возрастает при удалении от ядра. На некотором расстоянии вероятность достигает максимума, а затем медленно уменьшается, приближаясь к нулю на расстоянии, стремящемся к бесконечности (рис. 3). Таким образом, невозможно ограничить то пространство, в котором может находиться электрон, т. е. нельзя (без дополнительных условий) указать размеры атома.
 |
 |
Рис. 3.
Квантово-механическое моделирование пространства, занимаемого одним атомом, основано на допущении, что достаточно ограничить вероятность пребывания электрона объемом, который составляет 90 % (или еще точнее, 95%) от полного объема пространства вокруг атома, занимаемого электроном. Такой объем пространства называется атомной орбиталью.
Из-за корпускулярно-волновой природы электрона всегда существует некоторая неопределенность в установлении его места пребывания в атоме. Поэтому понятие «орбиталь» не следует трактовать только как путь движения частицы (такое понятие принято для орбиты в теории Бора), но и как траекторию распространения волны. Нельзя утверждать, что электрон находится в некоторый момент времени в данной точке пространства, но можно говорить о 90 % -ой вероятности его пребывания в ограниченном объеме пространства, которое и есть атомная орбиталь.
Обоснование орбитальной модели атома, исходящее из волнового характера электрона, состоит в следующем. Электрон заполняет пространство вокруг атомного ядра в форме стоячей волны, которую наглядно можно представить как электронное облако. Отрицательный заряд электрона оказывается неравномерно распределенным во всем объеме пространства вокруг атомного ядра (электрон как бы «размазан» или делокализован в этом объеме) (рис. 3).
 2015-01-07
2015-01-07 1980
1980
