Атомную орбиталь, имеющую шаровую симметрию, принято обозначать как s-орбиталь а находящиеся в ней электроны – как s-электроны.
На каждом энергетическом уровне в атоме имеется только одна s-орбиталь, которая включает (при максимальном ее заселении) два s-электрона.
|
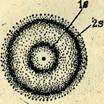
Радиус атомной s-орбитали возрастает при увеличении номера энергетического уровня; 1s расположена внутри 2s, последняя внутри 3s и т. д. с центром, отвечающим атомному ядру (рис. 4). В целом строение электронной оболочки атома в орбитальной модели представляется слоистым, Каждый энергетический уровень, содержащий электроны, геометрически рассматривается как электронный слой, хотя это понятие обычно более применимо в рамках модели Бора.
Рис. 4.
Для сокращенного обозначения электрона, занимающего атомную s-орбиталь, используется обозначение самой s-АО (приведенное выше) с верхним цифровым индексом, указывающим число электронов. Например, 1s1 – обо значение единственного электрона атома водорода.
Номер энергетического уровня отвечает главному квантовому числу, а вид орбитали – орбитальному квантовому числу.
Электронное строение атома водорода изображается следующим образом: 1s1, гелия – 1s2, лития – 1s22s1, бериллия – 1s22s2 .
Представленная запись строения электронной оболочки атома называется электронной формулой атома. Электронная формула в сочетании с энергетической диаграммой электронной оболочки атома отражают его электронную конфигурацию.
 2015-01-07
2015-01-07 614
614








