Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня неодинакова, электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s и 2р-подуровни), третий энергетический уровень – на три подуровня (3s, 3р- и 3d-подуровни) и т. д. Расщепление второго, третьего и четвертого энергетических уровней показано на рис. 9.
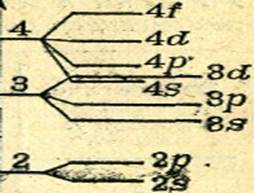
Рис.9.
Каждый s-подуровень содержит одну s-AО, каждый p-подуровень – три р-АО, каждый d-подуровень – пять d-АО и каждый f-подуровень – семь f-АО.
Энергетический уровень характеризуется главным квантовым числом n. Для всех известных элементов значения n изменяются от 1 до 7. Электроны в многоэлектронном атоме, находящемся в основном (невозбужденном) состоянии, занимают энергетические уровни от первого до седьмого.
Энергетический подуровень характеризуется орбитальным квантовым числом l. Для каждого уровня (n = const) квантовое число l принимает все целочисленные значения от 0 до (n - 1), например, при n = 3 значениями l будут 0, 1 и 2. Орбитальное квантовое число определяет геометрическую форму орбиталей.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г. швейцарским физиком Паули (принцип запрета Паули): в атоме не могут одновременно находиться два электрона в тождественных состояниях.
Два электрона, занимающие в атоме разные энергетические уровни и подуровни, находятся в различных квантово-механических состояниях. Различие электронов, занимающих разные атомные орбитали одного подуровня (n = const), кроме s-подуровня, характеризуется магнитным квантовым числом ml. Это число называется магнитным, поскольку оно характеризует поведение электронов во внешнем магнитном поле. Если значение l определяет геометрическую форму атомных орбиталей подуровня, то значение квантового числа устанавливает взаимное пространственное расположение этих орбиталей.
Магнитное квантовое число ml в пределах данного подуровня принимает все целочисленные значения от +l до -l, включая нуль. Для s-подуровня ml = 0.
Для р-подуровня ml может принимать три значения +1, 0, -1.
Таким образом, каждая атомная орбиталь однозначно определяется тремя квантовыми числами.
Сочетание трех квантовых чисел, характеризующих конкретную атомную орбиталь, выбирается из ансамбля всех возможных значений квантовых чисел.
В виду того, что каждая орбиталь может максимально заполняться двумя электронами, число электронов, которое может разместиться на каждом энергетическом уровне и подуровне, вдвое больше числа орбиталей на данном уровне или подуровне. Поскольку электроны, находящиеся в одной атомной орбитали, имеют одинаковые значения квантовых чисел n, l и ml, то для отличия двух электронов--на одной орбитали используется четвертое, спиновое квантовое число ms, которое определяется спином электрона. В соответствии c принципом Паули можно утверждать, что каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел.
Заселение электронами энергетических уровней, подуровней и атомных
орбиталей подчиняется следующему правилу: в невозбужденном атоме все электроны обладают наименьшей энергией.
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927 г.) (правило Хунда): атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем происходит их заполнение вторыми электронами.
 2015-01-07
2015-01-07 3393
3393